
ホーム > 研究所 > センター紹介 > 研究推進基盤センター > 研究室紹介 > バイオセーフティ管理室
〔最終更新〕 2025年6月16日
当研究室は、病原微生物や放射線等を安全に使用できるよう、施設設備ならびに研究材料の管理するとともに、研究者に対する教育訓練を担っています。あわせて、老化に伴う免疫機能低下のメカニズムを解明し、これを予防、改善することを目指した研究を行っています。
*詳しい内容については「研究概要」をご覧ください。
| 2025年6月12日 | Cell Biochemistry and Function誌に論文が掲載されました。 |
| 2025年6月7日 | 近藤研究員がJHリトリート2025で理事長賞を受賞しました。[写真(4380KB) ] ] |
| 2025年5月28日 | Frontiers in Immunology誌に論文が掲載されました。 |
| 2024年1月18日 | 近藤研究員が日本免疫学会で発表しました。 |
| 2023年6月26日 | 健康長寿ラボにコラム を掲載しました。 を掲載しました。 |
| 2023年6月22日 | New England Journal of Medicine誌に共同研究の成果を発表しました。[プレスリリース ] ] |
| 2023年6月16日 | 近藤研究員がIAGGと日本基礎老化学会で発表しました。 |
| 2023年2月28日 | Experimental Gerontology誌に共同研究の成果を発表しました。 |
| 2022年12月1日 | 近藤研究員が着任しました。 |
| 2022年10月26日 | Journal of Infection誌に論文が掲載されました。 |
| 2022年5月20日 | Journal of Infection誌に論文が掲載されました。解説 はこちら。 はこちら。 |
| 2022年5月1日 | 藤原研究員が豊橋創造大学助教に栄転しました。 |
| 2022年1月3日 | Immunity and Ageing誌に共同研究の成果を発表しました。 |
| 2021年12月10日 | 藤原研究員が日本免疫学会で発表しました。 |
| 2021年10月30日 | Journal of Infection誌に論文が掲載されました。解説 はこちら。 はこちら。 |
| 2021年8月29日 | GHM Open誌に論文が掲載されました。 |
| 2021年4月1日 | バイオセーフティ管理室に改称しました。 |
| 2020年8月31日 | 健康長寿ネットに記事 が掲載されました。 が掲載されました。 |
| 2020年7月6日 | RI管理区域と感染実験室のページを追加しました。 |
| 2020年4月1日 | 藤原研究員が着任しました。 |
| 2019年8月1日 | バイオセーフティ管理・研究室が発足しました。 |
RIを用いた実験を行うことができる管理区域が、第1研究棟内に2カ所設置されています。当研究室では、放射線障害防止法などの法令に則って安全かつ円滑に実験が遂行できるよう、管理区域ならびに共通機器の管理を行うとともに、利用者に対する教育、訓練を行っています。
生体物質や化合物に標識された非密封のRIを用いて、遺伝子やタンパクを解析したり、細胞や生体内での物質の分布、移動、変化を解析したりすることができる施設です。一般的な実験室の他に、細胞培養室、測定室、冷蔵室、暗室、動物飼育室などを有しており、RIを用いた様々な実験を行うことができます。動物飼育エリアには、X線照射装置とX線撮影装置が設置されています。

小動物用PET装置やサイクロトロンが設置されており、PETプローブを標識合成し、生体内でイメージングする実験を行うことができます。動物飼育室には個別換気ケージが設置されており、長期にわたって動物を飼育し、PETイメージングで繰り返し観察することを可能にしています。

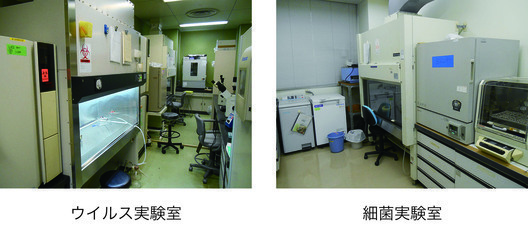
バイオセーフティレベル(BSL)2レベルの感染実験室で、ウイルス実験室と細菌実験室があります。細菌やウイルスと言った病原体を用いた実験や、ウイルスベクターを用いたP2レベルの遺伝子組換え実験を行うことができます。また、実験動物施設に、P2実験室とP3A実験室があり、実験動物を用いた感染実験を行うことができます。
| 室長 | 錦見昭彦 NISHIKIMI Akihiko |
|---|---|
| 連絡先 | a-nishikimi*ncgg.go.jp (*を@に変えて送ってください) |
| 経歴 |
国立長寿医療研究センター研究所 研究推進基盤センター センター長代理
|
| 専門分野 | 免疫学、生化学、細胞生物学 |
| 研究員 | 近藤遼平 KONDO Ryohei |
|---|---|
| 連絡先 | r-kondo*ncgg.go.jp (*を@に変えて送ってください) |
| 専門分野 | 再生医学、免疫学 |
| 研究補助員 | 廣川順子 HIROKAWA Junko |
|---|---|
|
十鳥夕子 TOTTORI Yuko |
|
| 山田あかね YAMADA Akane |
| RI管理室 | 今井康雄 IMAI Yasuo |
|---|
| 外来研究員 | 藤原光宏 FUJIWARA Mitsuhiro |
|---|
| 客員研究員 | 中西章 NAKANISHI Akira |
|---|
|
研究生 |
野本侑希 NOMOTO Yuki |
大学院生(博士課程・修士課程)、研究生を随時募集しております。詳細につきましては錦見までお問い合わせください。
ウイルスや細菌といった病原体などが感染することにより発症する病気が数多く知られています。免疫系は、これら病原体などの体内への侵入を感知して取り除くことにより、私たちの体を病原体から防御しています。また、私たちの免疫系は、過去に感染した病原体の情報を記憶し、同じ病原体が再度侵入した際に迅速かつ強力に対応する能力を備えています。予防接種などのワクチン投与はこの性質を利用しており、あらかじめ病原体の成分などを投与して免疫系に病原体の情報を記憶させ、実際に病原体が感染することを防いでいます。
病原体の情報は記憶細胞とよばれるリンパ球にが担っており、ひとつの細胞がそれぞれ特定の抗原の情報を記憶しています。加齢に伴って免疫担当細胞の供給が低下することに加え、様々な病原体の感染を経験することで記憶細胞の割合が増え、新たに侵入した病原体の情報を記憶する細胞をつくる余地が少なくなります。このような状態では、ワクチンを投与しても十分な記憶が形成されず、感染症に対する抵抗力が得られなくなります。特に、新型インフルエンザのような新たな病原体に対する抵抗力をつけることが難しくなります。
私たちの免疫系は、病原体を攻撃することで感染を防いでいるほか、病原体に狙いを定めることにより、自身の細胞や組織への損傷を最小限にとどめるようにしています。年齢を経ると、免疫担当細胞の攻撃能力が低下するだけでなく、特定の病原体に狙いを定める能力が衰えた細胞が増えてきます。その結果、弱い攻撃が長期間にわたって広範囲で続くことになり、慢性的な炎症につながります。
この研究では、免疫記憶が形成されるメカニズムや免疫担当細胞が老化するメカニズムを解明し、その結果に立脚して、高齢者でも十分な免疫記憶を誘導できる方法や、老化した細胞を取り除いて免疫機能を維持する方法を開発することを目指しています。
Fujiwara M, Kondo R, Sugiyama Y, Maruyama M, Nishikimi A. Increased Fascin1 and Pak1 expressions enhanceage-associated B-cell actin cytoskeleton remodeling and motility. Cell Biochem Funct (2025) 43: e70090. [full-text ]
]
Kondo R, Kondo, K, Nabeshima K, Nishikimi A, Ishida Y, Shigeoka T, Dijkstra JM. PD-1 is conserved from sharks to humans: new insights into PD-1, PD-L1, PD-L2, and SHP-2 evolution. Front Immunol (2025) 16: 1573492.
Ogiso N, Yuri S, Munesue Y, Nishikimi A, Watanabe A, Inui M, Takano K, Almunia JA, Niida S. Biological characteristics of age-related changes in C57BL/6 mice sub-strains in the National Center for Geriatrics and Gerontology Aging Farm. Exp Anim (2024) 74: 229-238.
Block J, Rashkova C, Castanon I, Zoghi S, Platon J, Ardy RC, Fujiwara M, Chaves B, Schoppmeyer R, van der Made CI, Jimenez Heredia R, Harms FL, Alavi S, Alsina L, Sanchez Moreno P, Ávila Polo R, Cabrera-Pérez R, Kostel Bal S, Pfajfer L, Ransmayr B, Mautner AK, Kondo R, Tinnacher A, Caldera M, Schuster M, Domínguez Conde C, Platzer R, Salzer E, Boyer T, Brunner HG, Nooitgedagt-Frons JE, Iglesias E, Deyà-Martinez A, Camacho-Lovillo M, Menche J, Bock C, Huppa JB, Pickl WF, Distel M, Yoder JA, Traver D, Engelhardt KR, Linden T, Kager L, Hannich JT, Hoischen A, Hambleton S, Illsinger S, Da Costa L, Kutsche K, Chavoshzadeh Z, van Buul JD, Antón J, Calzada-Hernández J, Neth O, Viaud J, Nishikimi A, Dupré L, Boztug K. Systemic inflammation and normocytic anemia in DOCK11 deficiency. N Engl J Med (2023) 389: 527-539.
Li J, Nakagawa T, Kojima M, Nishikimi A, Tokuda H, Nishimura K, Umezawa J, Tanaka S, Inoue M, Ohmagari N, Yamaguchi K, Takeda K, Yamamoto S, Konishi M, Miyo K, Mizoue T. Underlying medical conditions and anti-SARS-CoV-2 spike IgG antibody titers after two doses of BNT162b2 vaccination: A cross-sectional study. PLoS One (2023) 18: e0283658.
Sugiyama Y, Harada T, Kamei Y, Yasuda T, Mashimo T, Nishikimi A*, Maruyama M* (*corresponding authors). A senolytic immunotoxin eliminates p16INK4a-positive T cells and ameliorates age-associated phenotypes of CD4+ T cells in a surface marker knock-in mouse. Exp Gerontol (2023) 174:112130.
Nishikimi A, Nakagawa T, Fujiwara M, Watanabe K, Watanabe A, Komatsu A, Yasuoka M, Watanabe R, Naya M, Oshima H, Kitagawa Y, Tokuda H, Kondo I, Niida S, Sakurai T, Kojima M, Arai H. Humoral and cellular responses to the third COVID-19 BNT162b2 vaccine dose in research institute workers in Japan. J Infect (2023) 86: e33-e35.
Yamamoto S, Tanaka A, Ohmagari N, Yamaguchi K, Ishituka K, Morisaki N, Kojima M, Nishikimi A, Tokuda H, Inoue M, Tanaka S, Umezawa J, Okubo R, Nishimura K, Konishi M, Miyo K, Mizoue T. Use of heated tobacco products, moderate alcohol drinking, and anti-SARS-CoV-2 IgG antibody titers after BNT162b2 vaccination among Japanese healthcare workers. Prev Med (2022) 161: 107123.
Nishikimi A, Watanabe K, Watanabe A, Yasuoka M, Watanabe R, Fujiwara M, Oshima H, Nakagawa T, Kitagawa Y, Tokuda H, Washimi Y, Niida S, Kojima M. Immune responses to COVID-19 vaccine BNT162b2 in workers at a research institute in Japan: 6-month follow-up survey. J Infect (2022) 85: 174-176.
Sugiyama Y, Fujiwara M, Sakamoto A, Tsushima H, Nishikimi A, Maruyama M. The immunosenescence-related factor DOCK11 is involved in secondary immune responses of B cells. Immun Ageing (2022) 19: 2.
Nishikimi A, Watanabe K, Watanabe A, Yasuoka M, Watanabe R, Oshima H, Kitagawa Y, Tokuda H, Niida S, Kojima M. Prevalence of SARS-CoV-2 antibodies after one-year follow up among workers in a research institute in Japan. J Infect (2021) 84: e23-e25.
Nishikimi A, Kojima M, Watanabe K, Watanabe A, Yasuoka M, Oshima H, Tokuda H, Niida S. Seroprevalence of antibodies against SARS-CoV-2 among workers in a national research institute and hospital in Central Japan. GHM Open (2021) 1: 40-42.
Okumura F, Fujiki Y, Oki N, Osaki K, Nishikimi A, Fukui Y, Nakatsukasa K, Kamura T. Cul5-type ubiquitin ligase KLHDC1 contributes to the elimination of truncated SELENOS produced by failed UGA/Sec decoding. iScience (2020) 3: 100970.
Momoi Y, Nishikimi A, Du G, Kataoka T, Katagiri K. Phosphatidic acid regulates subcellular distribution of RA-GEFs critical for chemokine-dependent migration. Biochem Biophys Res Commun. (2020) 524: 325-331.
Ushijima M, Uruno T, Nishikimi A, Sanematsu F, Kamikaseda Y, Kunimura K, Sakata D, Okada T, Fukui Y. The Rac Activator DOCK2 Mediates Plasma Cell Differentiation and IgG Antibody Production. Front Immunol. (2018) 9: 243.
Nishikimi A, Koyama YI, Ishihara S, Kobayashi S, Tometsuka C, Kusubata M, Kuwaba K, Hayashida O, Hattori S, Katagiri K. Collagen-derived peptides modulate CD4+ T-cell differentiation and suppress allergic responses in mice. Immun Inflamm Dis. (2018) 6: 245-255.
Okumura F, Joo-Okumura A, Obara K, Petersen A, Nishikimi A, Fukui Y, Nakatsukasa K, Kamura T. Ubiquitin ligase SPSB4 diminishes cell repulsive responses mediated by EphB2. Mol Biol Cell. (2017) 28: 3532-3541.
Uematsu K, Okumura F, Tonogai S, Joo-Okumura A, Alemayehu DH, Nishikimi A, Fukui Y, Nakatsukasa K, Kamura T. ASB7 regulates spindle dynamics and genome integrity by targeting DDA3 for proteasomal degradation. J Cell Biol. (2016) 215: 95-106.
Okumura F, Uematsu K, Byrne SD, Hirano M, Joo-Okumura A, Nishikimi A, Shuin T, Fukui Y, Nakatsukasa K, Kamura T. Parallel Regulation of von Hippel-Lindau Disease by pVHL-Mediated Degradation of B-Myb and Hypoxia-Inducible Factor α. Mol Cell Biol. (2016) 36: 1803-1817.
Ishihara S, Nishikimi A, Umemoto E, Miyasaka M, Saegusa M, Katagiri K. Dual functions of Rap1 are crucial for T-cell homeostasis and prevention of spontaneous colitis. Nat Commun. (2015) 6: 8982.
Watanabe M, Terasawa M, Miyano K, Yanagihara T, Uruno T, Sanematsu F, Nishikimi A, Côté JF, Sumimoto H, Fukui Y. DOCK2 and DOCK5 act additively in neutrophils to regulate chemotaxis, superoxide production, and extracellular trap formation. J Immunol. (2014) 193: 5660-5667.
Nishikimi A, Ishihara S, Ozawa M, Etoh K, Fukuda M, Kinashi T, Katagiri K. Rab13 acts downstream of the kinase Mst1 to deliver the integrin LFA-1 to the cell surface for lymphocyte trafficking. Sci Signal. (2014) 7: ra72.
Ogawa K, Tanaka Y, Uruno T, Duan X, Harada Y, Sanematsu F, Yamamura K, Terasawa M, Nishikimi A, Côté JF, Fukui Y. DOCK5 functions as a key signaling adaptor that links FcεRI signals to microtubule dynamics during mast cell degranulation. J Exp Med. (2014) 11: 1156-1156.
Nishikimi A, Kukimoto-Niino M, Yokoyama S, Fukui Y. Immune regulatory functions of DOCK family proteins in health and disease. Exp Cell Res. (2013) 319: 2343-2349.
Kamakura S, Nomura M, Hayase J, Iwakiri Y, Nishikimi A, Takayanagi R, Fukui Y, Sumimoto H. The cell polarity protein mInsc regulates neutrophil chemotaxis via a noncanonical G protein signaling pathway. Dev Cell. (2013) 26: 292-302.
Sakai Y, Tanaka Y, Yanagihara T, Watanabe M, Duan X, Terasawa M, Nishikimi A, Sanematsu F, Fukui Y. The Rac activator DOCK2 regulates natural killer cell-mediated cytotoxicity in mice through the lytic synapse formation. Blood. (2013) 22: 386-393.
Sanematsu F, Nishikimi A, Watanabe M, Hongu T, Tanaka Y, Kanaho Y, Côté JF, Fukui Y. Phosphatidic acid-dependent recruitment and function of the Rac activator DOCK1 during dorsal ruffle formation. J Biol Chem. (2013) 288: 8092-8100.
Fujimori S, Hirai N, Ohashi H, Masuoka K, Nishikimi A, Fukui Y, Washio T, Oshikubo T, Yamashita T, Miyamoto-Sato E. Next-generation sequencing coupled with a cell-free display technology for high-throughput production of reliable interactome data. Sci Rep. (2012) 2: 691.
Terasawa M, Uruno T, Mori S, Kukimoto-Niino M, Nishikimi A, Sanematsu F, Tanaka Y, Yokoyama S, Fukui Y. Dimerization of DOCK2 is essential for DOCK2-mediated Rac activation and lymphocyte migration. PLoS One. (2012) 7: e46277.
Nishikimi A, Uruno T, Duan X, Cao Q, Okamura Y, Saitoh T, Saito N, Sakaoka S, Du Y, Suenaga A, Kukimoto-Niino M, Miyano K, Gotoh K, Okabe T, Sanematsu F, Tanaka Y, Sumimoto H, Honma T, Yokoyama S, Nagano T, Kohda D, Kanai M, Fukui Y. Blockade of inflammatory responses by a small-molecule inhibitor of the Rac activator DOCK2. Chem Biol. (2012) 19: 488-497.
Harada Y, Tanaka Y, Terasawa M, Pieczyk M, Habiro K, Katakai T, Hanawa-Suetsugu K, Kukimoto-Niino M, Nishizaki T, Shirouzu M, Duan X, Uruno T, Nishikimi A, Sanematsu F, Yokoyama S, Stein JV, Kinashi T, Fukui Y. DOCK8 is a Cdc42 activator critical for interstitial dendritic cell migration during immune responses. Blood. (2012) 119: 4451-61.
Hanawa-Suetsugu K, Kukimoto-Niino M, Mishima-Tsumagari C, Akasaka R, Ohsawa N, Sekine S, Ito T, Tochio N, Koshiba S, Kigawa T, Terada T, Shirouzu M, Nishikimi A, Uruno T, Katakai T, Kinashi T, Kohda D, Fukui Y, Yokoyama S. Structural basis for mutual relief of the Rac guanine nucleotide exchange factor DOCK2 and its partner ELMO1 from their autoinhibited forms. Proc Natl Acad Sci U S A. (2012) 109: 3305-3310.
Sanematsu F, Hirashima M, Laurin M, Takii R, Nishikimi A, Kitajima K, Ding G, Noda M, Murata Y, Tanaka Y, Masuko S, Suda T, Meno C, Côté JF, Nagasawa T, Fukui Y. DOCK180 is a Rac activator that regulates cardiovascular development by acting downstream of CXCR4. Circ Res. (2010) 107: 1102-1105.
Gotoh K, Tanaka Y, Nishikimi A, Nakamura R, Yamada H, Maeda N, Ishikawa T, Hoshino K, Uruno T, Cao Q, Higashi S, Kawaguchi Y, Enjoji M, Takayanagi R, Kaisho T, Yoshikai Y, Fukui Y. Selective control of type I IFN induction by the Rac activator DOCK2 during TLR-mediated plasmacytoid dendritic cell activation. J Exp Med. (2010) 207: 721-730.
Nishikimi A, Fukuhara H, Su W, Hongu T, Takasuga S, Mihara H, Cao Q, Sanematsu F, Kanai M, Hasegawa H, Tanaka Y, Shibasaki M, Kanaho Y, Sasaki T, Frohman MA, Fukui Y. Sequential regulation of DOCK2 dynamics by two phospholipids during neutrophil chemotaxis. Science. (2009) 324: 384-387.
Gotoh K, Tanaka Y, Nishikimi A, Inayoshi A, Enjoji M, Takayanagi R, Sasazuki T, Fukui Y. Differential requirement for DOCK2 in migration of plasmacytoid dendritic cells versus myeloid dendritic cells. Blood. (2008) 111: 2973-2976.
Tanaka Y, Hamano S, Gotoh K, Murata Y, Kunisaki Y, Nishikimi A, Takii R, Kawaguchi M, Inayoshi A, Masuko S, Himeno K, Sasazuki T, Fukui Y. T helper type 2 differentiation and intracellular trafficking of the interleukin 4 receptor-alpha subunit controlled by the Rac activator Dock2. Nat Immunol. (2007) 8: 1067-1075.
Kunisaki Y, Nishikimi A, Tanaka Y, Takii R, Noda M, Inayoshi A, Watanabe K, Sanematsu F, Sasazuki T, Sasaki T, Fukui Y. DOCK2 is a Rac activator that regulates motility and polarity during neutrophil chemotaxis. J Cell Biol. (2006) 174: 647-652.
Chen W, Nishikimi A, Kamata T, Adachi Y. A reducing and denaturing step maximizes the immunoprecipitations of m-calpain and I-2(PP2A)/SET: an approach toward antibodies that do not work well in immunoprecipitation. J Biochem Biophys Methods. (2006) 68: 65-68.
Uekawa N, Terauchi K, Nishikimi A, Shimada J, Maruyama M. Expression of TARSH gene in MEFs senescence and its potential implication in human lung cancer. Biochem Biophys Res Commun. (2005) 329: 1031-1038.
Nishikimi A, Meller N, Uekawa N, Isobe K, Schwartz MA, Maruyama M. Zizimin2: a novel, DOCK180-related Cdc42 guanine nucleotide exchange factor expressed predominantly in lymphocytes. FEBS Lett. (2005) 579: 1039-1046.
住所:〒474-8511 愛知県大府市森岡町7-430 国立長寿医療研究センター研究所
TEL:0562-46-2311(代表)
内線:5244
e-mail:a-nishikimi*ncgg.go.jp(*を@に変換してください)