プレスリリース
ホーム > 研究所 > 研究実績 > アルツハイマー病を超早期に検出する血液バイオマーカー リン酸化タウ(p-tau217)が、脳内のアミロイド斑に反応した神経シナプス活動を反映している可能性を見出しました
2025年9月3日
〜以前から用いられてきたリン酸化タウ(p-tau181)とは機能的に異なるバイオマーカーとして使用できる可能性〜
国立研究開発法人国立長寿医療研究センター
国立研究開発法人国立長寿医療研究センター(理事長:荒井秀典)研究所・認知症先進医療開発センター・神経遺伝学研究部の廣田湧研究員、榊原泰史研究員、関谷倫子副部長、飯島浩一部長らは、アルツハイマー病のリスクを超早期に診断する血液バイオマーカーとして注目されるリン酸化タウ(p-tau217)が、脳内に形成されたアミロイド斑の周囲にある神経シナプス活動を反映している可能性を、ヒトの剖検脳を用いた解析から明らかにしました。また、従来用いられてきたアルツハイマー病の診断バイオマーカー(リン酸化タウp-tau181)とは異なる脳の病変をとらえていることも明らかにし、両者が機能的に異なるバイオマーカーである可能性が示されました。本研究は、東京都健康長寿医療センターの齊藤祐子部長(神経病理・ブレインバンク)、国立精神・神経医療研究センターの髙尾昌樹部長(臨床検査部・総合内科部)との共同研究で行われました。
アルツハイマー病は認知症の最大の原因であり、記憶力や判断力などの認知機能が徐々に低下していく進行性の神経変性疾患です。この病気では、脳の中にアミロイドβがたまると(アミロイド斑)、神経細胞の中にリン酸化という修飾を受けたタウタンパク質がたまり始め(タウ病理)、それらが脳の広い範囲に拡がることで、神経細胞が失われて病気を発症すると考えられています。アルツハイマー病の原因と考えられるアミロイド斑は、症状が現れる20年以上も前から脳内にたまり始めます(図1・脳内の変化)。一方、タウ病理は、神経細胞死が起こり病気を発症する時期に認められます。アルツハイマー病は、発症した後では治療が難しいため、発症する前のプレクリニカル期に脳の病変をとらえるバイオマーカーの開発が飛躍的に進んでいます。なかでも、体への負担が少なくコストも低い血液バイオマーカーは、アルツハイマー病の早期診断法として注目されています。
タウタンパク質は、441個のアミノ酸が連なって構成されており、アルツハイマー病の脳内では過剰なリン酸化を受けています。中でも、その181番目のアミノ酸がリン酸化されたリン酸化タウ181(以降、p-tau181と記載)の「脳脊髄液」中での上昇が、アルツハイマー病による脳の病変を反映する体液バイオマーカーとして、臨床所見の診断補助に用いられてきました。その後、脳内から血液中にわずかに染み出してくる微量なタンパク質を、超高感度に検出する技術が開発され、p-tau181に加えて、217番目や231番目のアミノ酸がリン酸化されたタウタンパク質(p-tau217、p-tau231)の血液中での上昇が、アルツハイマー病を高い精度で鑑別することが報告されました(図1・血液中の変化)。なかでもp-tau217は、アルツハイマー病を発症前に検出できる有望な血液バイオマーカーとして注目されています。

図1.アルツハイマー病発症にいたるまでの脳病理の進行と血液バイオマーカーリン酸化タウの変化
血液中でのp-tau217の上昇は、脳内のアミロイド斑の蓄積をよく反映することから、無症候期から早期のアルツハイマー病の検出に有用であると考えられています。しかしこの時期には、脳内には顕著なタウ病理は認められないため、アミロイド斑の蓄積に伴い、なぜ血液中ではリン酸化されたタウ(p-tau217)が上昇するのかは不明でした。血液中のp-tau217が脳内のどのような変化を反映しているのかを理解することは、臨床の現場でp-tau217をバイオマーカーとして使用する上でもとても重要です。
これまでに、脳内にアミロイド斑を呈するアルツハイマー病モデルマウスを用いて、p-tau217がアミロイド斑を取り囲むシナプス(神経細胞同士のつなぎ目)に現れることを報告してきました(Brain Commun. 2022, 4(6), fcac286. 過去のプレスリリース )。そこで本研究では、同様の変化がヒトの脳でも見られるのかを明らかにするために、日本ブレインバンクネットの協力の下、認知機能健常からアルツハイマー病のプレクリニカル期、そしてアルツハイマー病までの様々な病理ステージにあるヒト剖検脳を用いて、アミロイド斑の形成に伴いp-tau217が脳内のどこに、どのように出現するのかを詳しく調べました。
)。そこで本研究では、同様の変化がヒトの脳でも見られるのかを明らかにするために、日本ブレインバンクネットの協力の下、認知機能健常からアルツハイマー病のプレクリニカル期、そしてアルツハイマー病までの様々な病理ステージにあるヒト剖検脳を用いて、アミロイド斑の形成に伴いp-tau217が脳内のどこに、どのように出現するのかを詳しく調べました。
本研究では、脳に顕著な病変がない認知機能健常の高齢者(健常)、アミロイド斑のみを呈する認知機能健常から軽度認知障害期の高齢者(プレクリニカル期)、そしてアミロイド斑もタウ病理もあるアルツハイマー病の高齢者の計35人分の大脳皮質を用いて、アミロイド斑の形成に伴い、p-tau217は脳のどこに最初に現れるのか、またp-tau181やp-tau231などの他のリン酸化タウの出現や分布とどのような関係にあるのかを、免疫組織学的手法を用いて詳しく調べました。
その結果、p-tau217はアミロイド斑がない健常高齢者の脳では全く検出されませんでしたが(図2・健常)、アルツハイマー病のプレクリニカル期になると、アミロイド斑の周囲に点状のシグナルとして出現することが分かりました(図2・プレクリニカル期)。一方、予想されたように、アルツハイマー病の脳ではp-tau217は神経細胞の中に蓄積して、タウ病理(神経原線維変化)を形成していました(図2・アルツハイマー病)。
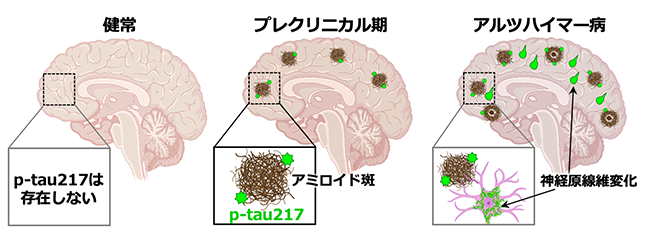
図2.p-tau217はアミロイド斑が形成されると出現する
次に、アミロイド斑の周囲で認められるp-tau217の点状のシグナルが、プレクリニカル期の脳のどこにたまっているのかを詳しく調べました。アミロイド斑の周辺を、顕微鏡を使って高い倍率で撮像し、その写真を画像解析ソフトウェアで3D構築したところ、p-tau217の点状のシグナルは、神経細胞同士のつなぎ目であるシナプスに局在していることがわかりました(図3)。さらに、p-tau217とともに注目されるp-tau231もまた、アルツハイマー病のプレクリニカル期になるとアミロイド斑の周囲に点状のシグナルとして出現し、シナプスに局在することが分かりました(図4)。
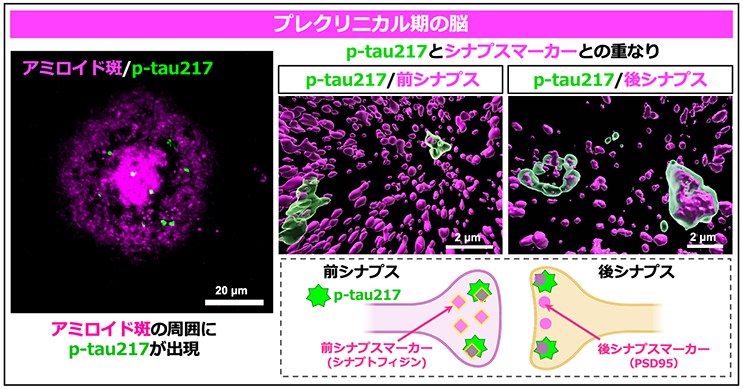
図3.プレクリニカル期のアミロイド斑周囲のシナプスに出現するp-tau217
一方で、アルツハイマー病の診断を補助する体液バイオマーカーとして昔から用いられてきたp-tau181は、p-tau217やp-tau231とは様相が全く違っていました。p-tau181は、p-tau217やp-tau231とは異なり、健常者の脳にも豊富に存在し、神経細胞の中でも興奮性神経細胞や抑制性神経細胞など、アルツハイマー病で傷害される神経細胞の軸索やシナプスに局在していました。さらに、これらのp-tau181陽性の神経軸索や神経シナプスは、プレクリニカル期の脳に形成されたアミロイド斑の周囲で変性したように膨らんでおり、そこにp-tau217が出現することを見出しました(図4)。これらの結果から、p-tau217の方がp-tau181よりも高い精度でアルツハイマー病を検出できる理由として、p-tau217は健常な脳には存在せず、アミロイド斑の形成とともに脳内に現れることが考えられました。
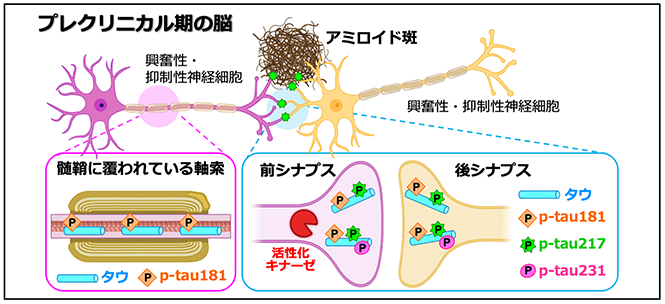
図4.アルツハイマー病プレクリニカル期におけるリン酸化タウタンパク質の局在
では、p-tau217がアミロイド斑の周囲のシナプスに出現することは、何を意味しているのでしょうか?神経細胞や神経シナプスは傷ついたり変性したりすると、周囲にいるグリア細胞によって貪食されることが知られています。そこで、p-tau217陽性のシナプスがダメージを受けているかを調べるために、グリア細胞がp-tau217のシグナルを活発に貪食しているかを調べました。しかし予想とは異なり、p-tau217が存在する神経シナプスは、他の神経シナプスと比べても、グリア細胞により貪食される割合が極めて低いことが分かりました。
そこで逆に、p-tau217が存在するシナプスは、その活動が高まった結果として肥大化している可能性を考えました。活性化したシナプスでは、さまざまなシグナルや酵素の働きが高まっています。詳しく調べたところ、p-tau217が存在するシナプスでは、タウをリン酸化する酵素の働きが高まっており、これらのシナプスが活性化していたことが示唆されました。
本研究により、アルツハイマー病のプレクリニカル期に血液中で増加するp-tau217は、脳内のアミロイド斑の周囲で神経活動が高まった結果としてシナプスでリン酸化を受けたp-tau217が、血液中に染み出してきたものを反映している可能性が示されました。今後、脳内のp-tau217がどのようにして血液中に染み出してくるのか、また、抗アミロイド抗体医薬の投与後に、アミロイド斑とともにp-tau217も一緒に消失するのかを明らかにする研究が重要だと考えています。
もう一つ重要なこととして、アルツハイマー病を超早期に検出する血液バイオマーカーp-tau217が、脳内にアミロイド斑ができたことをとらえるのに対して、以前からアルツハイマー病の診断に用いられてきたp-tau181は、p-tau181を豊富に含む神経細胞が脳の中で壊れていく様子をとらえている可能性が明らかになりました。このことは、p-tau217とp-tau181が、機能的に異なるバイオマーカーとして使用できる可能性を示しています。
今回の成果は、アルツハイマー病を発症前に検出する血液バイオマーカーと脳内の変化の関係を明らかにするとともに、アルツハイマー病の発症メカニズムの解明や、予防・治療法を開発する上での手掛かりとなります。今後は、本研究の知見を基に、より精度の高い早期診断法の確立や、病気を発症する前に脳病態の進行を抑止する新たな治療法の開発につなげていきたいと考えています。
本研究成果は、令和7年9月3日付けで米国科学誌Cell Reportsにonlineで掲載されました。本研究は、日本医療研究開発機構(AMED)認知症研究開発事業、科研費(日本学術振興会科学研究費助成事業)、堀科学芸術振興財団、国立長寿医療研究センター長寿医療研究開発費からの研究助成を受けて行われました。
Yu Hirota*, Yasufumi Sakakibara*, Maho Morishima, Terunori Sano, Manato Hara, Akira Arakawa, Masaki Takao, Shigeo Murayama, Yuko Saito, Michiko Sekiya#, Koichi M. Iijima#, “Biomarker-related phospho-tau217 appears in synapses around Aβ plaques prior to tau tangles in cerebral cortex of preclinical Alzheimer’s disease”, Cell Reports, 2025, online.
*共同筆頭著者、#共同責任著者
国立長寿医療研究センター研究所・認知症先進医療開発センター
神経遺伝学研究部 部長:飯島浩一、副部長:関谷倫子
電話:0562(46)2311(内線 6401/6408)
E-mail:iijimakm@ncgg.go.jp
国立長寿医療研究センター総務部総務課広報担当 総務係長(広報担当)
〒474-8511 愛知県大府市森岡町七丁目430番地
電話:0562(46)2311(代表)
E-mail:webadmin@ncgg.go.jp
@を全角表示しております。メール送信にあたっては、半角の@に直してお送りください。
![]()