健康長寿ラボ
前回 は、米国FDAがアデュカヌマブを条件付き承認とした経緯をお話ししました(なお、日本の厚生労働省は継続審議としました)。“条件付き”の承認となった理由は、アデュカヌマブにアミロイド斑を減らす効果があることを認めつつも、正式に承認するためには、認知機能を確かに改善する効果があることを、追加の臨床試験で確認する必要があると判断されたからです。今回は、前編・後編の2回に渡り、アデュカヌマブが期待したほどには認知機能を改善できなかったのはなぜか、アルツハイマー病の治療薬開発が難航している理由、そして今後の臨床試験をどのように進めようとしているのか、について解説します。
は、米国FDAがアデュカヌマブを条件付き承認とした経緯をお話ししました(なお、日本の厚生労働省は継続審議としました)。“条件付き”の承認となった理由は、アデュカヌマブにアミロイド斑を減らす効果があることを認めつつも、正式に承認するためには、認知機能を確かに改善する効果があることを、追加の臨床試験で確認する必要があると判断されたからです。今回は、前編・後編の2回に渡り、アデュカヌマブが期待したほどには認知機能を改善できなかったのはなぜか、アルツハイマー病の治療薬開発が難航している理由、そして今後の臨床試験をどのように進めようとしているのか、について解説します。
本コラムの第1回 で、抗体医薬の最初の試みとして、患者さんの体内でアミロイドβに対する抗体を作らせる、ワクチン接種の臨床試験が行われたことをお話ししました。残念ながらこの臨床試験は、数%の患者さんに深刻な副作用(脳を覆う髄膜の炎症)が見られたために中止されました。実は、この話には後日談があります。
で、抗体医薬の最初の試みとして、患者さんの体内でアミロイドβに対する抗体を作らせる、ワクチン接種の臨床試験が行われたことをお話ししました。残念ながらこの臨床試験は、数%の患者さんに深刻な副作用(脳を覆う髄膜の炎症)が見られたために中止されました。実は、この話には後日談があります。
ワクチン療法に、ヒトの脳の中からアミロイドβを減らす効果が本当にあったのかを調べるために、臨床試験に参加した患者さんのうち22名について、15年間に渡る追跡調査が行われました。患者さんの死後に行われた脳病理解析から、アミロイドβに対する抗体が体の中でたくさん出来ていた人ほど、脳の中のアミロイド斑が少なくなっていることが明らかになりました(文献1)。しかし、脳の中のアミロイド斑が減少した患者さんにおいても、ワクチン療法による認知機能の改善効果は認められませんでした(文献1)。
また最近になり、アデュカヌマブの投与を受けた患者さんの死後脳を用いた病理解析の結果も報告されました(文献2)。生前に受けた脳画像診断で、アデュカヌマブの投与によりアミロイド斑が減少している様子が観察されていましたが、死後脳の病理解析により、その診断に間違いがなかったことが確認されました。また、さらに詳しい解析から、アデュカヌマブの投与により脳の中のミクログリアという細胞が刺激されて、アミロイド斑を取り込んで分解している可能性が高いこと、アミロイド斑の周りの神経へのダメージが若干ながらも回復していること、さらにアデュカヌマブの投与による脳への深刻なダメージは見られないこと、などが明らかになりました。
臨床試験には、膨大なお金と時間がかかり、様々な批判もありましたが、私たちは重要な事実を知ることになりました。それは、アルツハイマー病を発症した後に、抗体医薬などで脳からアミロイド斑を減らしても、認知機能の低下を止めることはできない、またはその効果は限定的であるということです。
この結果を受けて、研究者の中からは、そもそもアミロイド斑だけでアルツハイマー病の発症や進行を説明するのには無理があるのではないか、という批判の声があがりました。実際、アルツハイマー病を発症した患者さんの脳には、アミロイド斑だけではなく、タウと呼ばれるタンパク質の蓄積や、脳組織の炎症、脳血管のダメージ、そして神経細胞の脱落といった様々な病変が見られます。しかし、アミロイド斑はアルツハイマー病に特徴的な病変であり、また遺伝性のアルツハイマー病の原因となる遺伝子の変異により脳のアミロイド斑が増えることから、アミロイド斑がアルツハイマー病の原因であることに間違いはないようです。そこで研究者たちは、アルツハイマー病の治療薬開発を正しく進めていくためにも、アミロイドβに対する抗体医薬が認知機能を改善しなかった理由の解明に取り組みました。
治療薬の効果を調べるためには、その薬が効果を発揮すると想定される病気の患者さんに薬を投与する必要があります。実は最近まで、アルツハイマー病の診断を確定するためには、記憶障害などの臨床症状に加えて、患者さんの死後に脳の病理解析を行い、アミロイド斑、タウタンパク質が凝集した神経原線維変化(以下、タウ病理とします)、そして脳の萎縮という、アルツハイマー病に特徴的な脳の病変があることを確認する必要がありました(図1・左)。抗体医薬が開発される前から、アルツハイマー病の治療薬の臨床試験は数多く行われていました。しかし、アルツハイマー病だと思った患者さんが実は別の病気だったなど、生前の確定診断の難しさが、治療薬の開発を難航させた理由の一つに挙げられます。実際、先にお話ししたワクチン療法の追跡調査でも、22名中の5名(23%)は、死後脳の病理解析の結果、アルツハイマー病ではなかったことが明らかになっています。
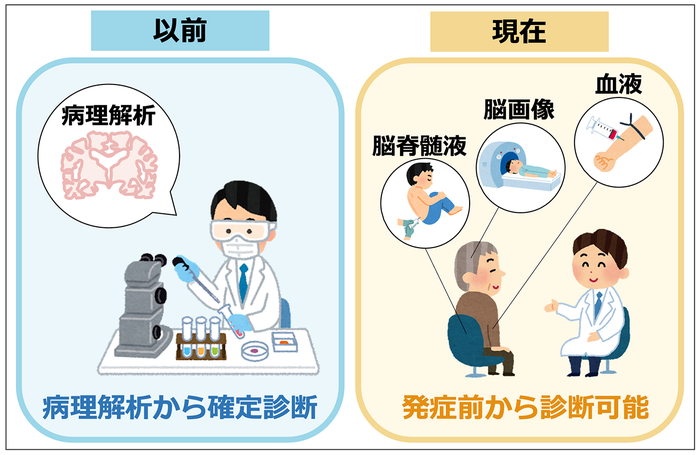
図1.アルツハイマー病の診断
そこで、生前にアルツハイマー病を正確に診断する方法の開発が進められました。まず、脳と直接行き来することができる体液(脳脊髄液と言います)に含まれる、アミロイドβやタウタンパク質の量を測定することで、脳の病変を推測する方法が開発され、アルツハイマー病と他の原因で起こる認知症を見分けることが可能になりました(図1・右)。また、核医学検査の一つの陽電子放出断層撮影(positron emission tomography:略称PET)の技術が向上し、脳の中でアミロイド斑やタウ病理がたまっている様子を観察できるようになりました。この方法では、アミロイド斑やタウ病理に特異的に結合する薬剤を放射性物質でラベルして、血液中に投与します。その後、脳の中でその薬剤がアミロイド斑やタウ病理にくっついた様子を、薬剤から出る放射線をPETの技術でとらえることで画像化し分析します(図1・右)。しかし、脳脊髄液を採取するのは体への負担が非常に大きく、気軽には患者さんにすすめられません。またPETで脳画像を見る方法は、体への負担に加え、非常にお金のかかる検査です。つまり、たくさんの人が検査を受けるためには、もっと簡単な方法が必要です。
この問題を解決すべく、ここ数年の間に血液中のアミロイドβやタウタンパク質を測定することで、アルツハイマー病の脳病変を検出する方法が開発され、実用化に向けて世界中でしのぎを削る競争が行われています(図1・右)。当研究センターが島津製作所と共同で開発した方法は、世界でもトップクラスの精度でアルツハイマー病を検出できると認められて、2018年にネイチャー誌で発表されました(文献3)。このように、まず血液中のアミロイドβやタウタンパク質の量を測定し、必要に応じて脳脊髄液やPETを用いた検査を行うことで、アルツハイマー病を発症する前に、脳の中で生じている変化を正確にとらえることが可能になりつつあります。これらの方法を使うことで、より精度の高い臨床試験を行うことができるようになると期待されています。
(後編につづく)


 .
. )
)![]()