健康長寿ラボ
前回 は、アデュカヌマブがアミロイドβを標的とする抗体医薬の一つで、アルツハイマー病の進行を止める可能性のある、新しいタイプの薬であることをお話ししました。今回はアデュカヌマブの臨床試験について解説します。
は、アデュカヌマブがアミロイドβを標的とする抗体医薬の一つで、アルツハイマー病の進行を止める可能性のある、新しいタイプの薬であることをお話ししました。今回はアデュカヌマブの臨床試験について解説します。
これまでに、アミロイドβに対する様々な抗体医薬が開発され、臨床試験が進められてきました。これらのうち、最初に臨床試験が行われた抗体医薬は、ヤンセン(Janssen)社とファイザー(Pfizer)社が開発したバピネウズマブ(Bapineuzumab)という抗体です。臨床試験は、軽度から中等度のアルツハイマー病を発症した患者さんに対して行われ、2014年にその結果が報告されました。バピネウズマブの投与により、一部の患者さんで脳に溜まったアミロイドβが減る様子が見られましたが、残念ながら認知機能の改善や病気の進行を遅くする効果は認められませんでした(文献1)。
また同じく2014年に、イーライリリー(Eli Lilly)社が開発したソラネズマブ(Solanezumab)という抗体医薬の臨床試験の結果も報告されました。こちらの臨床試験も、軽度から中等度のアルツハイマー病患者さんを対象に行われましたが、残念ながらソラネズマブの投与による認知機能への効果は見られませんでした(文献2)。
これらの臨床試験の結果を受けて、多くの製薬企業や医学研究者の間では、アミロイドβの抗体医薬に対する悲観論が広がっていきました。
このような状況の中、登場したのがアデュカヌマブです。アデュカヌマブは、バピネウズマブやソラネズマブとは少し違うところがあります。前回お話ししたとおり、健常なヒトの脳の中にもアミロイドβはありますが、アルツハイマー病の患者さんの脳の中では、老化や生活習慣病などの理由で、たくさんのアミロイドβがくっついてアミロイド斑というかたまりになって溜まっています(前回の図1) 。
。
バピネウズマブやソラネズマブは、単独で存在するアミロイドβにくっつくように設計されています(図1)。つまり、アミロイドβがアミロイド斑になるのを抗体医薬で防ごう、という考え方です。それに対して、アデュカヌマブはアミロイドβの小さなかたまりや、より大きなかたまりのアミロイド斑に特徴的な形を認識してくっつきます(図1)。そのため、アルツハイマー病の原因と考えられるアミロイド斑を、より効率的に脳から取り除くことができると考えられています。
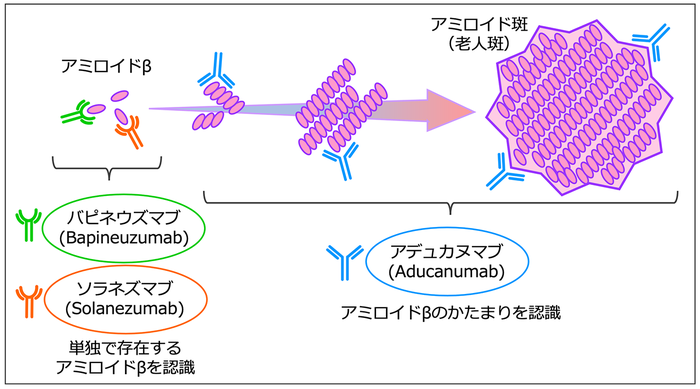
図1.アデュカヌマブとバピネウズマブ、ソラネズマブとの違い
アデュカヌマブについては、3件の臨床試験が行われました。簡単に言うと、最初に行われた小規模の臨床試験では薬の効果が認められたものの、その後で行われた2つの大規模な臨床試験では、効果が見込めないという判定が下され、臨床試験の中止が発表されました(図2)。以下に、詳しい経緯をお話しします。
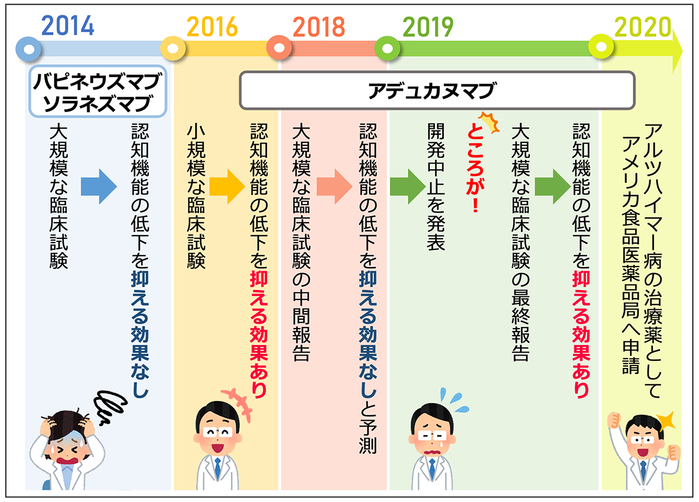
図2.これまでの抗体医薬の臨床試験
まず2016年に、軽度認知障害(アルツハイマー病を発症する一歩手前の段階と考えられています)の方と軽度のアルツハイマー病患者さん125名に対して行われた、プライム(PRIME)試験と呼ばれる臨床試験の結果が発表されました(図2)。この臨床試験では、アデュカヌマブの投与により、脳内のアミロイド斑が減少し、さらに認知機能の改善効果も認められました(文献3)。
また2015年頃から、バイオジェン社とエーザイ社により、エマージ(EMERGE)試験とエンゲージ(ENGAGE)試験と呼ばれる、2件の大規模な臨床試験(第3相試験)が行われました。大規模な臨床試験には莫大な費用がかかることから、臨床試験を継続すべきか否かを決定するための中間解析が行われます。試験の途中にあたる2018年12月に、18ヶ月間の投与が完了した1748人分の被験者のデータ(エマージ試験803人分、エンゲージ試験945人分)をもとに、最終的に薬の効果が見られるかどうかを予測する解析(専門用語で無益性解析と言います)が行われました(図2)。その結果、アデュカヌマブの投与をこれ以上継続しても、認知機能の改善効果が見られない可能性が高いという予測になりました。この結果を受けて、2019年3月バイオジェン社とエーザイ社は、アデュカヌマブの臨床試験を中止すると発表しました(図2)。
しかし、ここから前代未聞の展開が待っています。バイオジェン社とエーザイ社は、臨床試験の中止を発表した後に、追加で集めたデータを全て合わせて、アデュカヌマブには、認知機能を改善する効果が本当に見られないのかを、解析し直しました。先に述べた、臨床試験の結果を予測する中間解析は1748人分のデータでしたが、最終解析では3285人分(エマージ試験1638人分、エンゲージ試験1647人分)のデータが用いられました。
その結果、エマージ試験の方で、アデュカヌマブを高用量で投与した患者さんに、認知機能の低下を抑える効果が認められました。また脳の中のアミロイド斑は、アデュカヌマブを低用量で投与した患者さんでも、高用量で投与した患者さんでも減少していることが確認されました。もう一つのエンゲージ試験の方では、アデュカヌマブが認知機能の低下を抑える効果は認められなかったものの、高用量を投与した一部の患者さんを対象とした解析では、効果が認められる可能性があると発表されました。
なぜ臨床試験の途中で行われた中間解析による予測と、大規模データを用いた最終解析が異なる結果になったのでしょうか?バイオジェン社とエーザイ社はその主な理由として、臨床試験の中止の後に集まったデータには、投与計画の変更により、アデュカヌマブを高用量で長期間投与したデータが多く含まれていたため、と説明しています。一連の臨床試験の結果に基づいて、2019年10月、バイオジェン社とエーザイ社はアメリカ食品医薬品局(U.S. Food and Drug Administration: 略称FDAです)にアデュカヌマブを生物薬剤として2020年初頭に申請すると発表しました(図2)。
次回は、FDAがアデュカヌマブを条件付き承認とした理由とその後の騒動、またアデュカヌマブをはじめとする、抗体医薬開発の最新の情報について解説します。
 )
)![]()