プレスリリース
2025年12月17日


国立研究開発法人 国立長寿医療研究センター
地方独立行政法人 東京都健康長寿医療センター
不明な点が多い嗜銀顆粒性認知症※1について遺伝学的解析を行い、この疾患の遺伝的特徴を世界で初めて明らかにしました。
認知症の中でもまだ理解が進んでいない嗜銀顆粒性認知症(Dementia with grain=DG)の患者ゲノム解析を行い、疾患に特異的な遺伝的特徴があることを国立長寿医療研究センター(理事長:荒井秀典)と東京都健康長寿医療センター(理事長:秋下雅弘)の合同研究チーム※が世界で初めて明らかにしました。
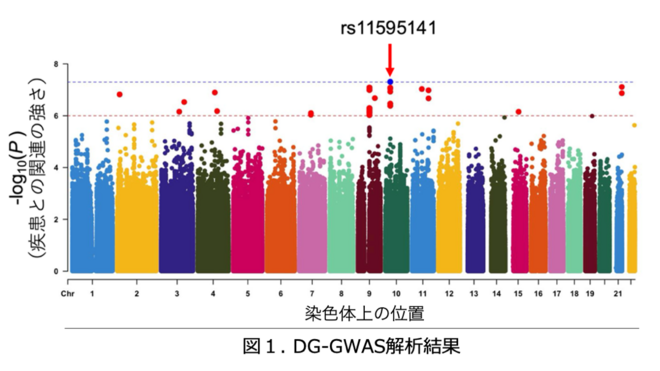
合同研究チームは、日本人のDG群と認知機能正常者群(Cognitive Normal=CN)合わせて12,619人のゲノム解析を実施し、10番染色体上にDG発症のリスクとなる一塩基多型(SNP)※2を見出しました。
遺伝子型-組織発現国際コンソーシアム(GTExプロジェクト)※3の公開データベースを用い、脳の遺伝子発現情報とDGの遺伝的特徴を組み合わせた解析からはアポトーシス(細胞の自然死)に関連する遺伝子DAPK2※4がリスクとして同定されました。
また、アルツハイマー型認知症(Alzheimer’s disease=AD)※5やDGと同じ4リピートタウオパシー※6に分類される進行性核上性麻痺(しんこうせいかくじょうまひ/PSP)※7や大脳皮質基底核変性症(だいのうひしつきていかくへんせいしょう/CBD)※8といった認知症とDGの遺伝学的な差を調べると、DGに特異的な遺伝的特徴があることがわかりました。
この研究成果は、遺伝医学・ゲノム医学分野の国際科学誌「Journal of Human Genetics」に2025年12月17日付で掲載されます。
研究所長特任補佐 新飯田俊平
理事長 兼 センター長 秋下雅弘
名誉理事長 鳥羽研二
嗜銀顆粒性認知症はADのアミロイドβともレビー小体型認知症※9のαシヌクレイン※10とも異なるタンパク質の過剰蓄積を伴うタイプの認知症です。この顆粒は神経細胞の微小管を作るタウタンパク質※8ですが、このタンパク質が過剰に作られると神経線維の変性が起こり、細胞死を起こします。高齢者の約5から9%にこのタンパク質の蓄積があると言われています。この顆粒の蓄積が海馬から皮質へと広がると認知症を発症すると考えられており、顆粒蓄積を伴う神経変性疾患の22%がDGを患っているとも推定されています。症状としては怒りっぽく、頑固という性格的変化が起き、時に暴力行為を起こすことなどが特徴として挙げられます。しかし、正確な診断には、脳組織の嗜銀顆粒を染め出す特殊な病理組織学的な検査を行うしかありません。詳しい環境要因や遺伝的要因もほとんど報告されていません。診断の困難さからしばしばADと誤診されることもあるようです文献。またADと併存することも知られています。疫学情報に比べ基礎医学的情報の少ないDGについては病態解明、治療法開発に資する基礎研究が急務です。
本研究では、DG群と、AD群ならびに認知機能正常高齢者群(Cognitive Normal=CN)のゲノム情報を用い、DG発症のリスクとなる遺伝的特徴の探索を行いました。東京都健康長寿医療センターブレインバンクが保有するDG患者と両研究機関のバイオバンクが保有する正常群の網羅的な一塩基多型(SNP)情報を用いゲノムワイド関連解析(GWAS)※11を実施しました(図1)。その結果、ゲノムワイド有意性(統計値Pが5 × 10-8未満、図1:青線超)を示す1つの座位※12(rs11595141※13)を同定しました。
また、このGWAS統計値とGTExから抽出した脳での網羅的遺伝子発現データを統合解析した結果、前頭葉におけるDAPK2※4遺伝子発現と強く関連性があることを見出しました。DAPK2はDeath associated protein kinaseの一種で、アポトーシス(細胞の自然死)やオートファジー(細胞の自食作用)を触媒する酵素のひとつです。この遺伝子ファミリーの一つDAPK1※4はADの発症に関連することが知られています。
さらに、最も一般的な認知症であるAD、およびDGと同じ4リピートタウオパシーに分類される進行性核上性麻痺(しんこうせいかくじょうせいまひ/PSP)と大脳皮質基底核変性症(だいのうひしつきていかくへんせいしょう/CBD)では遺伝的特徴がDGと異なるかをAPOE※14とMAPT※6という2つの遺伝子におけるSNP関連解析を用いて調べました。APOE遺伝子は2つのSNP(rs429358, rs7412)によって3つのアレル型※15(e2, e3, e4)に分類されます。そのうちe4はAD発症リスクが非常に高いことが知られています。MAPT遺伝子は嗜銀顆粒を構成するタウタンパク質をコードする遺伝子です。MAPT遺伝子のH1/H2アレル変異はPSPとCBDの高いリスクになると報告されています。
まず、DGとCN間でAPOEアレル型を決定する2つのSNPを比較しましたが関連を示しませんでした(P = 0.41)(図2a)。一方、DGとAD間では、rs7412は関連を示しませんでしたが(P = 0.28)、rs429358では非常に強い関連を示しました(P = 6.25 × 10-9)(図2b)。
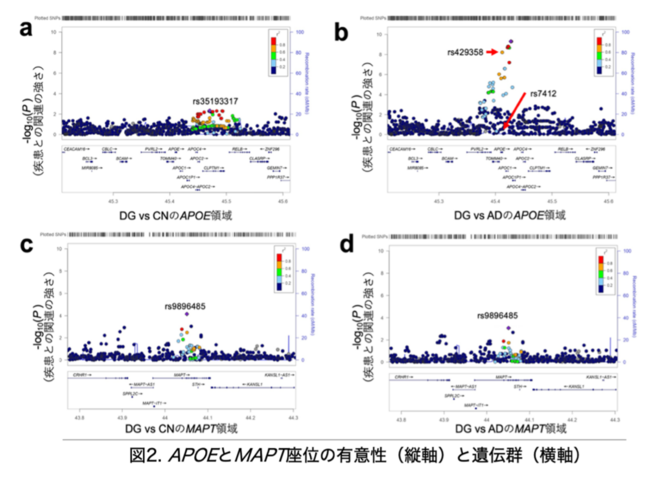
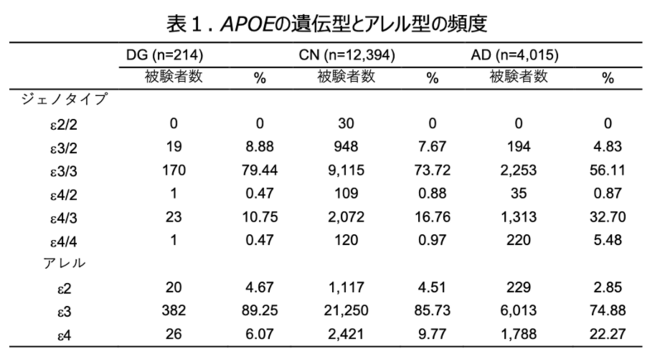
そこでe4の保有頻度をDG/AD群とCN間で確認したところDGのe4保因者数はADに比べわずかしかいないことがわかりました(表1)。同様にMAPT遺伝子について比較したところ、DGとCN間、DGとAD間のそれぞれでrs9896485が新規の関連変異であることが示されました(図2c, d)。このことはDGの遺伝的性質がADやPSP/CBDとは異なことを示しています。
日本人ゲノムデータから世界で初めてDGに関連するリスク遺伝子が同定され、それらの遺伝的特徴を明らかにしたことは、DG病理を深めることのみならず、複雑な病態を示す認知症病理を理解する上で重要な知見と考えられます。特にAOPEがDG発症のリスクとならないことは注目すべき点です。しばしばDGがADに包括されがちであることを考えるとAPOEのADに対する影響力については再考する必要があることを示唆しています。さらに、今回見つかったMAPT遺伝子の変異箇所は、同じタウオパチー疾患であるPSPやCBDとは異なる遺伝的特徴を示しており、DG病理のみならず認知症の層別化や診断法開発に寄与するものと考えられます。
Kovacs GG. Neuropathology of tauopathies: principles and practice. Neuropathol Appl Neurobiol. 2015 Feb;41(1):3-23. doi: 10.1111/nan.12208.
国立長寿医療研究センター 総務部総務課
国立長寿医療研究センター 研究所 メディカルゲノムセンター
センター長 尾崎浩一
※(at-markを「@」に置き換えてください)
※(at-markを「@」に置き換えてください)
![]()