プレスリリース
2024年7月30日
国立研究開発法人 国立長寿医療研究センター
名古屋大学大学院医学系研究科神経内科学の勝野 雅央 教授、平賀 経太 医員(筆頭著者)らの研究グループは、国立研究開発法人 国立長寿医療研究センターおよび国立研究開発法人 量子科学技術研究開発機構との共同研究で、神経変性疾患のひとつであるレビー小体病(パーキンソン病とレビー小体型認知症を合わせた名称)の発症前および発症後の段階におけるアルツハイマー病の合併を、患者と予備群の血液バイオマーカーを用いて解析しました。
レビー小体病はα-シヌクレインの神経細胞内蓄積を病理学的特徴とする神経変性疾患であり、パーキンソン病とレビー小体型認知症を含む疾患概念です。近年、レビー小体病ではα-シヌクレインに加え、併存するアルツハイマー病理(アミロイドβとタウ*8の蓄積)が認知症の出現や進行に関与することが剖検脳を用いた研究で報告されていましたが、こうしたアルツハイマー病の変化がいつから出現するのかは明らかではありませんでした。
本研究では、パーキンソン病患者84名、レビー小体型認知症患者16名に加え、勝野教授らの研究グループが開発した、アンケートによるレビー小体病発症リスク検出法(Hattori et al. J Neurol 267(5):1516-1526, 2020, Hattori et al. NPJ Parkinsons Dis 9:1-9, 2023)を用いて抽出したハイリスク者(予備群)82名、ローリスク者(健康な方)37名を対象に、血液中のアルツハイマー病のバイオマーカー(アミロイドβ、リン酸化タウ181)と神経変性マーカー(ニューロフィラメント軽鎖)を測定しました。
その結果、パーキンソン病患者とレビー小体型認知症患者ではアルツハイマー病に関連した変化がみられましたが、未発症のハイリスク者ではアルツハイマー病の血液バイオマーカーに変化がみられませんでした。一方で、神経変性マーカーはハイリスク者、パーキンソン病患者、レビー小体型認知症患者のいずれにおいても上昇していました。
以上の結果から、パーキンソン病やレビー小体型認知症の併存アルツハイマー病変化は発症前の段階ではみられず、発症後の段階になってから生じ始めることが示唆されました。また、神経変性マーカーであるニューロフィラメント軽鎖を用いることでα-シヌクレインによる神経障害を発症前の段階から検出できる可能性が示唆されました。
本研究成果は、2024年7月31日付(日本時間7月31日18時)米国科学雑誌『npj Parkinson’s Disease』に掲載されます。
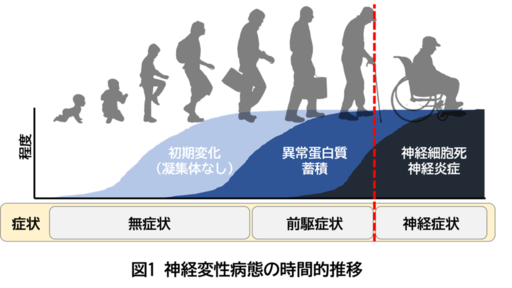
認知症を含む神経変性疾患では異常蛋白質の蓄積が臨床症状の発症に20年以上先行して生じることが明らかになってきており、発症前に病態を抑制することが重要であると考えられています(図1)。レビー小体病はα-シヌクレインの神経細胞内蓄積を病理学的特徴とする神経変性疾患であり、パーキンソン病とレビー小体型認知症を含む疾患概念です。パーキンソン病は動作緩慢などの運動障害と認知機能障害を呈し、国内患者数は20万人程度と推定されています。一方、レビー小体型認知症は国内患者数60〜90万人程度と推定され、アルツハイマー型認知症に次いで頻度の高い認知症であり、幻視などの認知機能障害とパーキンソン病に似た症状を呈します。近年、レビー小体病のプロドローマル症状(前触れ症状)として、便秘などの自律神経障害、嗅覚低下、レム睡眠行動異常症*9などが、運動症状や認知機能障害が出現する10〜20年前から認められることが注目されており、将来レビー小体病を発症する方を未病の段階で発見するのに重要であると考えられています。
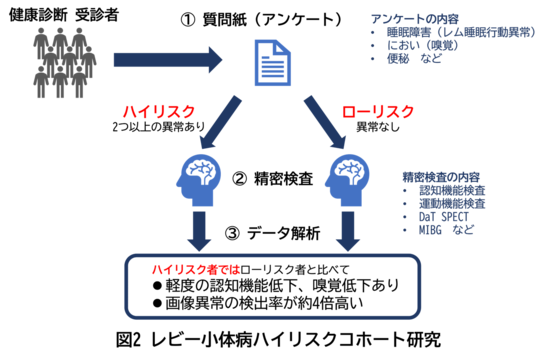
私たちの先行研究では、50歳以上の健常者の5.7%が2つ以上のプロドローマル症状を有しており、この集団をレビー小体病発症リスクの高いハイリスク群と定義しました(Hattori et al. J Neurol 267(5) : 1516-1526, 2020)。ハイリスク者(予備群)の方を詳しく評価すると、プロドローマル症状を持たないローリスク者と比較して、軽度認知機能低下と嗅覚低下を示し、約3分の1でレビー小体病患者と同様のドーパミントランスポーターシンチグラフィー(DaT SPECT)*10やMIBG心筋シンチグラフィー*11の画像異常を認めることがわかりました(Hattori et al. NPJ Parkinsons Dis 9 : 1-9, 2023)(図2)。
パーキンソン病とレビー小体型認知症では、α-シヌクレイン病理が認知症に関与していることが知られていますが、剖検脳を用いた先行研究ではレビー小体型認知症患者の70%以上、パーキンソン病認知症患者の約50%と高率にアルツハイマー病理の合併を認め、アルツハイマー病の変化も認知機能障害の出現や進行に関与することが示されています。アルツハイマー病に対する抗体医薬が本邦で承認されたこともあり、レビー小体病のアルツハイマー併存病理は治療標的となる可能性があり、その理解はとても重要です。アルツハイマー病では認知症を発症する20年以上前から異常蛋白であるアミロイドβが蓄積することが知られていますが、これまでレビー小体病における併存アルツハイマー病理がいつから出現するのかは明らかになっていませんでした。
今回、パーキンソン病患者84名、レビー小体型認知症患者16名に加え、ハイリスク者82名、ローリスク者37名を対象に血液中のアルツハイマー病関連バイオマーカー(アミロイドβ、リン酸化タウ181)と神経変性マーカー(ニューロフィラメント軽鎖)を測定し、レビー小体病発症前および発症後の段階におけるアルツハイマー病の合併について明らかにすることを目的に本研究を実施しました。
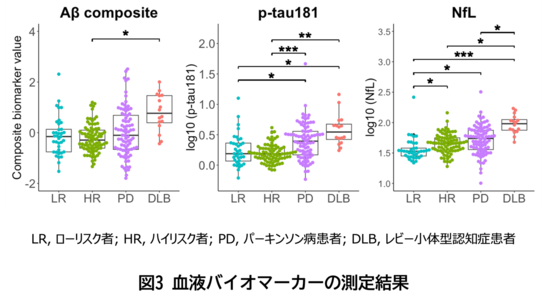
血液中のバイオマーカーを測定した結果、認知機能障害のあるパーキンソン病患者とレビー小体型認知症患者では、ローリスク者と比較してアルツハイマー病関連バイオマーカーであるアミロイドβ(Aβ composite)やリン酸化タウ181(p-tau181)の上昇がみられた一方で、ハイリスク者ではアルツハイマー病関連バイオマーカーの上昇はみられませんでした。また、神経変性マーカーであるニューロフィラメント軽鎖(NfL)については、ローリスク者と比較して、パーキンソン病患者、レビー小体型認知症患者のみならずハイリスク者においても上昇していることが明らかとなりました(図3)。
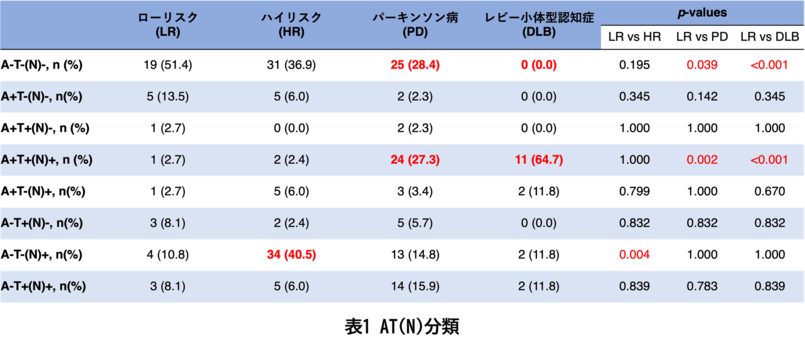
アミロイドβ(A)、タウ(T)、神経変性(N)の有無(+/−)を評価し、アルツハイマー病理の進展状態を分類すると、パーキンソン病患者とレビー小体型認知症患者ではローリスク者と比較してA+T+(N)+、すなわち併存アルツハイマー病理を有する患者が多いのに対し、ハイリスク者ではA-T-(N)+、すなわち併存アルツハイマー病理は認めないものの神経変性が認められる状態の方が多いことが明らかとなりました(表1)。
パーキンソン病患者では、アミロイドβ(Aβ composite)は認知機能と、リン酸化タウ181(p-tau181)は運動症状、非運動症状と、ニューロフィラメント軽鎖(NfL)は認知機能、運動症状、非運動症状と関連しており、アルツハイマー病変化が認知・運動機能に影響していると考えられました。一方、ハイリスク者ではこれらの臨床症状との関連は認めませんでしたが、神経変性マーカーであるニューロフィラメント軽鎖(NfL)の高い人ではMIBG心筋シンチグラフィ画像異常率が高いことがわかりました。
これらの結果から、パーキンソン病やレビー小体型認知症の併存アルツハイマー病理は発症前の段階には認めず、発症後の段階になってから出現し始めることが示唆されました。また、ハイリスク者ではアルツハイマー病関連バイオマーカーの上昇がないにも関わらず、神経変性マーカーであるニューロフィラメント軽鎖(NfL)の上昇が認められたことから、ニューロフィラメント軽鎖(NfL)を用いることでα-シヌクレインによる神経障害を発症前の段階から検出できる可能性が示唆されました。
本研究の結果から、レビー小体病に合併するアルツハイマー病変化は発症前の段階ではみられず、発症後から出現し始めることが示唆されました。近年、早期アルツハイマー病患者に対する抗アミロイドβ抗体医薬が登場し、レビー小体病の併存アルツハイマー病理も将来治療標的となる可能性があります。現在、本研究グループではレビー小体病ハイリスク者の1年毎の評価を継続しています。レビー小体病の併存アルツハイマー病理がいつから出現し、神経機能の予後にどのような影響を与えるのか、レビー小体病患者およびハイリスク者を縦断的に追跡し評価することでさらに明らかにしていきたいと考えています。
本研究は、国立研究開発法人日本医療研究開発機構の次世代治療・診断実現のための創薬基盤技術開発事業(研究課題名:血液バイオマーカーによる認知症の統合的層別化システムの開発:BATON研究)、認知症研究開発事業(研究課題名:血液バイオマーカーを用いた超早期アルツハイマー病コホートの構築:STREAM)、および臨床研究・治験推進研究事業(研究課題名:レビー小体病ハイリスク者に対するゾニサミドの有効性・安全性に関する特定臨床研究)の支援を受けて実施いたしました。
論文タイトル:Plasma biomarkers of neurodegeneration in patients and high risk subjects with Lewy body disease
著者名・所属名:Keita Hiraga, MD1, Makoto Hattori, MD, PhD1, Yuki Satake, MD1,2, Daigo Tamakoshi, MD1,Taiki Fukushima, MD1, Takashi Uematsu, MD1,Takashi Tsuboi, MD, PhD1, Maki Sato1, Katsunori Yokoi,MD, PhD3,Keisuke Suzuki, MD, PhD4, Yutaka Arahata, MD, PhD3,Yukihiko Washimi, MD, PhD5, Akihiro Hori, MD, PhD6,Masayuki Yamamoto, MD, PhD6, Hideaki Shimizu, MD, PhD7,Masakazu Wakai, MD, PhD8, Harutsugu Tatebe, PhD9,Takahiko Tokuda, MD, PhD9, Akinori Nakamura, MD, PhD10,Shumpei Niida, PhD11, Masahisa Katsuno, MD, PhD1,12
東海国立大学機構 名古屋大学大学院医学系研究科 神経内科学
教授 勝野 雅央(かつの まさひさ)
TEL:052-744-2389 FAX:052-744-2384
E-mail: ka2no(at-mark)med.nagoya-u.ac.jp
(「at-mark」を「@」に置き換えてください)
国立研究開発法人 国立長寿医療研究センター バイオマーカー研究開発部 HP
部長 中村 昭範(なかむら あきのり)
TEL:0562-46-2311 FAX:0562-48-2373
E-mail: nakamura(at-mark)ncgg.go.jp
(「at-mark」を「@」に置き換えてください)
東海国立大学機構 名古屋大学医学部・医学系研究科 総務課総務係
TEL:052-744-2804 FAX:052-744-2785
E-mail:iga-sous(at-mark)t.mail.nagoya-u.ac.jp
(「at-mark」を「@」に置き換えてください)

東海国立大学機構は、岐阜大学と名古屋大学を運営する国立大学法人です。
国際的な競争力向上と地域創生への貢献を両輪とした発展を目指します。
東海国立大学機構HP https://www.thers.ac.jp/

国立研究開発法人 国立長寿医療研究センター 総務部総務課総務係長(広報担当)
TEL:0562-46-2311 FAX:0562-48-2373
E-mail: webadmin(at-mark)ncgg.go.jp
(「at-mark」を「@」に置き換えてください)
国立長寿医療研究センターHP
![]()