研究実績
2021年7月20日
アルツハイマー病をはじめとした多くの認知症において、タウ(注釈1)という蛋白質が脳内に蓄積し、認知症の症状と相関することが以前より知られています。その蓄積したタウの量を評価することは病態を把握する上で極めて重要ですが、これまで脳内のタウの蓄積が正確に定量評価されることはほとんどありませんでした。今回、我々は定量性(注釈2)に優れるELISA(注釈3)と呼ばれる生化学的手法に着目しました。タウに対する認識部位の異なる抗体を利用した複数のELISAを比較することで、アルツハイマー病の人の脳組織におけるタウの蓄積を正確に識別、評価する測定手法を開発し報告しました。この結果は、Journal of Neuropathology and Experimental Neurology誌に2021年7月20日付(JST)で掲載されました。
今回、国立長寿医療研究センター(理事長:荒井秀典)の認知症先進医療開発センター、分子基盤研究部の篠原充副部長、里直行部長のグループは東京都健康長寿医療センターの村山繁雄 現大阪大学特任教授、齊藤祐子研究部長らとの共同研究により、アルツハイマー病者脳組織内において蓄積したタウを定量評価するELISAを開発しました。ELISAは2種類の抗体を利用しますが、今回当研究グループは認識部位の異なる6種類の抗体を組み合わせた網羅的検討を行った結果、特に中間部位からC末端(注釈4)部位の抗体を組み合わせたELISAが、神経病理診断によるタウのBraak ステージ5)とよく相関し、アルツハイマー病者を精度良く見分けられることが分かりました(図1)。さらに10箇所以上の脳部位で蓄積するタウの量を測定すると、Braakステージ(注釈5)で定義される、病態初期には一部の辺縁系(注釈6)にのみ限局した広がりを示すなどと一致することも分かりました(図2)。
本手法の導入により、これまで定量性に限界があることが指摘されていた病理組織学的手法(注釈7)を補完する形で、脳内のタウの蓄積量を定量評価し、病態を把握することが可能になると考えられます。このことは近年検討されているタウを標的とした治療法の有効性を評価するにあたり非常に重要です。今後は、当研究グループがこれまでアミロイドβに対して検討してきたようにタウがなぜ脳内で領域特異的に蓄積するのかを明らかにすることにより、アルツハイマー病の病態解明に役立てるとともに、近年発展の著しい血液や髄液、核医学によるタウのバイオマーカー評価(注釈8)と組み合わせた際の検討や、前頭側頭葉型認知症、大脳皮質基底核変性症といったアルツハイマー病以外のタウが蓄積する認知症疾患においてもタウの定量が有効かどうか検証していきたいと考えています。
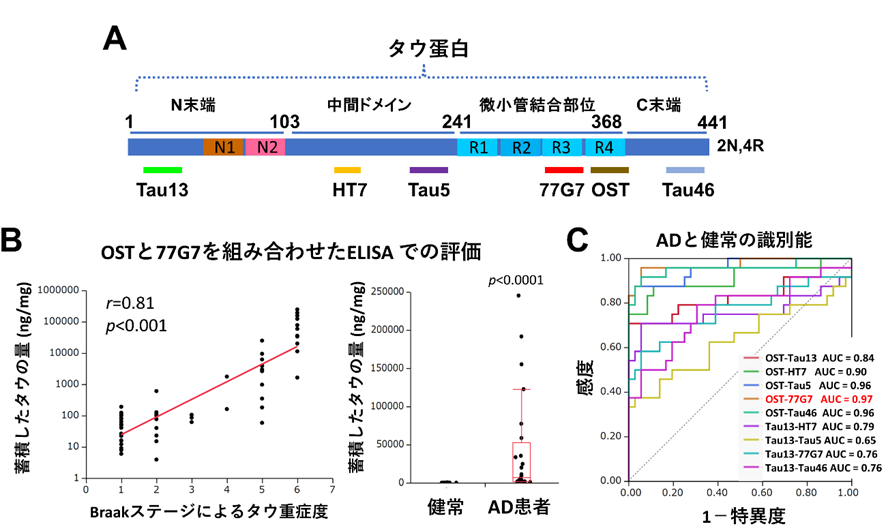
図1.アルツハイマー病患者の脳内のタウ蓄積を正確に識別、評価するタウELISAの開発
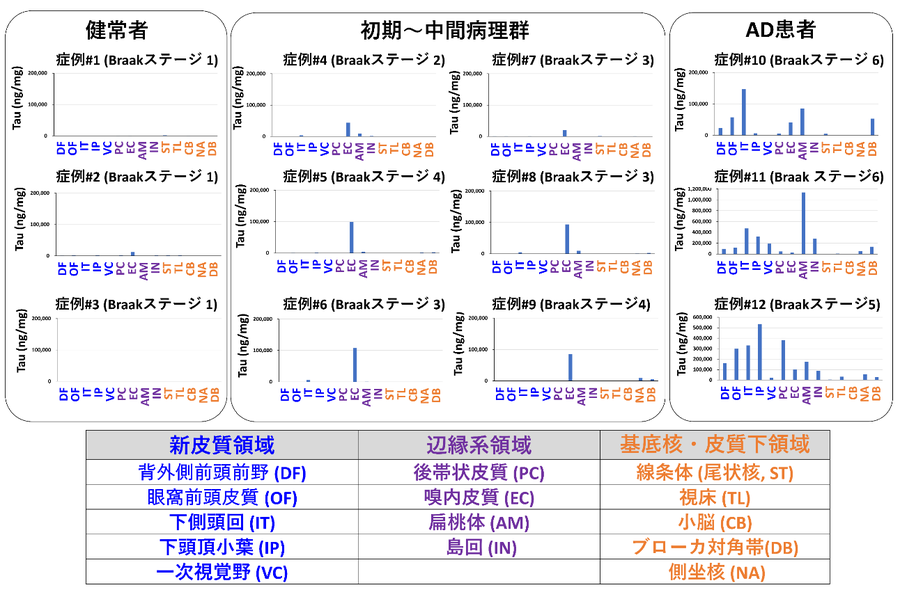
図2.開発したELISAによる、脳内でのタウ蓄積の広がりの評価
今回開発したELISAを用いると病気の段階や病気の種類に特徴的な脳内でのタウ蓄積の広がりが評価できる。
Mitsuru Shinohara, Junko Hirokawa, Akemi Shimodaira, Yoshitaka Tashiro, Kaoru Suzuki, Ghupurjan Gheni, Akio Fukumori, Tomoyasu Matsubara, Maho Morishima, Yuko Saito, Shigeo Murayama, Naoyuki Sato
ELISA Evaluation of Tau Accumulation in the Brains of Patients with Alzheimer Disease
Journal of Neuropathology and Experimental Neurology, 2021, in press.
国立研究開発法人 国立長寿医療研究センター
認知症先進医療開発センター分子基盤研究部
副部長 篠原充 あるいは 部長 里直行
〒474-8511 愛知県大府市森岡町七丁目430番地
電話 0562(46)2311(内線 6331) E-mail:shinohara(at-mark)ncgg.go.jp(篠原) or nsato(at-mark)ncgg.go.jp(里)
※(at-mark)を「@」に置き換えてください
国立長寿医療研究センター総務部総務課総務係長 里村亮
電話 0562(46)2311(内線 4623) E-mail:r-satomura(at-mark)ncgg.go.jp
※(at-mark)を「@」に置き換えてください
![]()