研究実績
2020年06月23日
国立研究開発法人 国立長寿医療研究センター
血液検査による認知症診断:実用化を加速 認知症の早期診断や効果的な予防法・治療法の開発に貢献
国立長寿医療研究センターを中心とした研究グループは、認知症の診断や認知症未発症の方の発症リスク予測等を血液検査で可能にするシステムの実用化に向け、産学連携の多施設共同研究「血液バイオマーカーによる認知症の統合的層別化システムの開発」(略称BATONプロジェクト)に着手致しました。
本プロジェクトは、日本医療研究開発機構の支援を受け注1、東京都健康長寿医療センター、国立量子科学技術研究開発機構、近畿大学、名古屋大学、株式会社島津製作所、東レ株式会社との共同研究体制で行われます。

認知症高齢者は現在日本で500万人以上、世界では5,000万人以上と推定され、その対策は我が国のみならず世界的に喫緊の課題となっています。認知症の根本的な治療法や有効な予防法を開発していくためには、多数の集団の中から、脳に認知症の原因となる病変がある人を正確に同定(層別化)していく必要があります。しかし、これには現状PET検査注2や髄液検査といった高額・あるいは侵襲性が高い方法しかないため、コスト・安全性・簡便性等の面で優れた血液検査による層別化システムの開発が強く求められています。
国立長寿医療研究センターと株式会社島津製作所は、最近、認知症の過半数を占めるアルツハイマー病の脳内アミロイドβ(Aβ)蓄積を高精度にとらえる血液バイオマーカーの開発に成功したことを報告致しました[1, 2]。これは、アルツハイマー病の治療薬や予防法の開発にブレークスルーをもたらす技術として世界的に注目され、実用化が強く期待されています。したがって、この血液Aβバイオマーカーの臨床応用を早期に実現することが、本プロジェクトの第一の目標です。このために、国立長寿医療研究センター、東京都健康長寿医療センター、近畿大学医学部の3施設共同で、2020年6月より前向き研究を開始し、島津製作所と協力して3年以内の実用化を目指します。
一方、認知症全般の対策のためには、Aβ以外の血液バイオマーカーを開発していくことも重要です。アルツハイマー病に限定しても脳の病態進行メカニズムは複雑で、Aβ蓄積後に、タウ蛋白の蓄積、神経変性といったプロセスが進行するため、最近ではアルツハイマー病を”ATN”(Amyloid, Tau, Neurodegenerationそれぞれの頭文字)で層別化して病態進行を把握するようになってきました。タウ蓄積をとらえるのも現状ではPET検査や髄液検査が必要となりますが、国立量子科学技術研究開発機構の徳田らは、世界ではじめて血液検査で脳のタウ蛋白の蓄積を推定できることを報告しており[3, 4]、更に神経変性に伴って増加するとされるNFL (neurofilament light chain)という蛋白質を血液で測定する技術も確立しています。また、東レ株式会社は、血液中のマイクロRNAを解析することにより、アルツハイマー病に次いで頻度の高い神経変性疾患のレビー小体型認知症の鑑別ができる可能性を報告しています。名古屋大学の勝野らは、レビー小体型認知症を発症前にとらえる大規模研究に取り組んでいるため、本プロジェクトによりレビー小体型認知症の早期診断に役立つバイオマーカーの開発も期待されます。更に、東レ株式会社は、血液マイクロRNA解析が、脳血管性認知症の鑑別や軽度認知障害から認知症への移行予測に有用である可能性も報告しています[5]。
本プロジェクトの最終的な目標は、これらの血液バイオマーカーの臨床的有用性を検証し、血液Aβバイオマーカーと組み合わせることによって、血液検査による認知症の統合的層別化システムを開発していくことです(図1)。これらの検証は、国立長寿医療研究センターのバイオバンクや、名古屋大学の臨床研究で保存された既存試料を用いて進め、必要に応じて他の大規模研究との共同研究も視野に入れながら、5年以内の実用化を目指します。
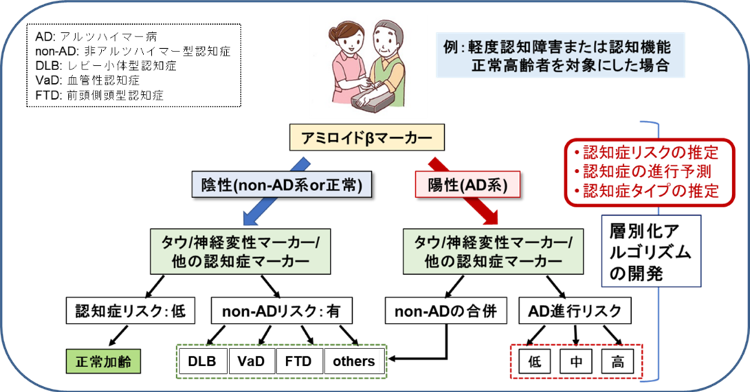
図1:血液バイオマーカーによる統合的層別化システム
本研究開発により、主に次の3つの医療・社会的貢献が期待されます(図2)。
現在アルツハイマー病の治験の多くにおいて、PET検査を行ってAβ蓄積を確認することが被験者の組み入れ条件とされており、これがコストや効率の面から治験の大きな阻害要因になっています。血液検査によるスクリーニングで事前の層別化が可能となれば、これらの問題を改善し、治療薬開発に大きく貢献すると期待されます。また、治療効果をモニタリングする際にも、安全に繰り返し検査が行える本システムは力を発揮すると期待されます。
認知症を臨床症状のみで正確に鑑別診断することは容易ではないため、診療の現場では病理や病態を反映するバイオマーカー情報が求められています。血液検査によりこれらの情報が得られるようになれば、認知症の鑑別診断に有用で、治療方針の決定や進行予測に基づくケアプランの立案にも役立つと期待されます。また、PET検査や髄液検査の前段階の検査として用いることも可能で、それによって患者さんの負担や医療・介護コストの削減にも貢献できます。
これまでに認知症の効果的な予防法を開発する研究はさかんに行われてきましたが、大規模集団をバイオマーカーで層別化することは現実的に不可能だったため、脳の背景病理や病態と照らし合わせて介入効果を詳細に評価することができませんでした。血液検査によって層別化が可能となれば、認知症の効果的な予防法を開発するための研究を促進する大きな原動力となると考えられます。また、将来的には高齢者健診に応用することにより、認知症高リスク者に対する早期介入やリスク管理、生活習慣の改善等による発症予防に役立てることができれば、高齢者の健康寿命の延長に寄与し、認知症対策コストの低減にもつながると期待されます。
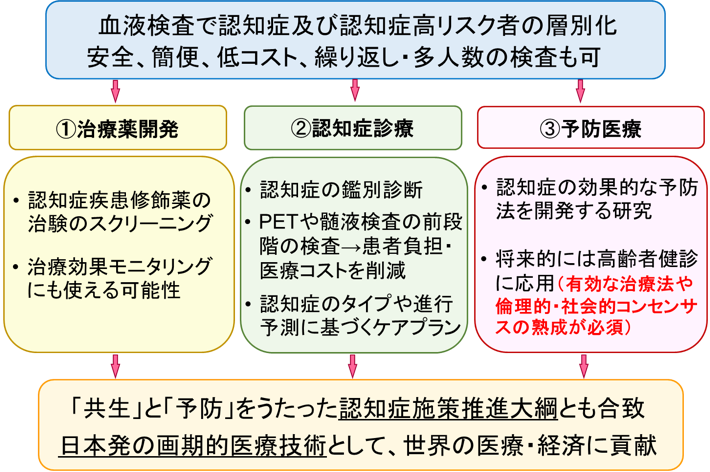
図2:本研究開発によって期待される医療・社会的貢献
血液検査でアミロイド、タウ、その他の神経病理学的な変化をとらえるバイオマーカーを開発して統合していく研究 (Blood-based Amyloid, Tau and Other Neuropathological Biomarkers Project) を略してBATONとしました。本プロジェクトは、たとえば治療薬の開発のように「直接ゴールを決める」研究ではありませんが、認知症の有効な治療法や予防法の開発を加速するために必要不可欠な研究です。また、安全、簡便、安価な方法で認知症の診断や認知症リスクの推定に役立つ情報を捉え、認知症診療の現場や一般高齢者にお届けできるようにすることも目指しています。
このように、認知症研究者、製薬企業、臨床診療医、一般高齢者の皆様等に「バトンを繋ぐ」という意味で、シンボルをバトンパスのイメージにしました。また陸上競技のリレーのように、日本が誇る技術とチームワークで世界にアピールし、人類の医療に貢献していくという意味も込められてあります。

| 国立長寿医療研究センター 認知症先進医療開発センター バイオマーカー開発研究部 | 中村昭範 |
| 東京都健康長寿医療センター研究所 神経画像研究チーム | 石井賢二 |
| 国立量子科学技術研究開発機構 放射線医学総合研究所 | 徳田隆彦 |
| 近畿大学医学部 放射線医学教室放射線診断学部門 | 石井一成 |
| 名古屋大学大学院医学系研究科 神経内科学 | 勝野雅央 |
| 株式会社島津製作所 田中耕一記念質量分析研究所 | 金子直樹 |
| 東レ株式会社 先端融合研究所 | 信正均 |
| 国立長寿医療研究センター | |
| 認知症先進医療開発センター/治験・臨床研究推進センター | 伊藤健吾 |
| 治験・臨床研究推進センター | 鈴木啓介 |
| 研究所/メディカルゲノムセンター | 新飯田俊平 |
| 病院 もの忘れセンター | 櫻井孝 |
| 病院 放射線診療部/認知症先進医療開発センター 脳機能画像診断開発部 | 加藤隆司 |
| 病院 神経内科部 | 新畑豊 |
本研究は、地域、および国における新型コロナウイルスの発生状況を注意深くモニターし、研究にご参加いただく方や、研究にかかわるスタッフの安全を十分に確保した上で行われます。
国立研究開発法人国立長寿医療研究センター
認知症先進医療センター 脳機能画像診断開発部
AMED層別化マーカー中村班研究事務局
TEL: 0562-46-2311(内線5212) E-mail: batn-jim@ncgg.go.jp
国立研究開発法人国立長寿医療研究センター 総務係長 里村亮
TEL: 0562-46-2311(内線4623) E-mail: r-satomura@ncgg.go.jp
次世代治療・診断実現のための創薬基盤技術開発事業(患者層別化マーカー探索技術の開発)/医療ニーズの高い特定疾患・薬剤に対する患者層別化基盤技術の開発:分担研究開発課題名「血液バイオマーカーによる認知症の統合的層別化システムの開発」(研究開発代表者:国立長寿医療研究センター 中村昭範)
陽電子放射断層撮影、またはポジトロンCTとも言います