研究実績
2020年02月04日
国立長寿医療研究センター・認知症先進医療開発センター・アルツハイマー病研究部の 関谷倫子 室長、飯島浩一 部長は、大阪大学大学院医学系研究科 菊地正隆 特任講師、中谷明弘 特任教授、新潟大学脳研究所 原範和 特任助教、池内健 教授らとともに、アルツハイマー病(Alzheimer’s disease: AD)における認知機能低下の原因となる神経細胞死のメカニズムの一端を明らかにしました。
ADは認知症の中でもっとも罹患者の割合が多く、その数は年々増加しています。AD患者の脳では、神経細胞内に神経原線維変化(NFT:neurofibrillary tangle)※1と呼ばれる異常なタンパク質の凝集体が観察されます。NFTは記憶を司る海馬や嗅内皮質に蓄積し始め、徐々に新皮質へ蓄積が拡大していきます。それに伴い神経細胞が脱落した結果、認知機能が低下すると考えられており、この病態の進行の度合いはBraak NFTステージと呼ばれています。しかしBraak NFTステージの進行が、どのようなメカニズムを介して神経細胞死を引き起こすのかは明らかになっていません。
今回研究グループは、日本人のアルツハイマー病患者の3つの脳部位(嗅内皮質、前頭皮質、側頭皮質)において、Braak NFTステージの進行に伴う遺伝子発現の変化を網羅的に解析しました(図1、左)。次に各遺伝子の発現変化が、AD患者の脳の中でどのような不具合を引き起こすのかを予測するために、上記の遺伝子発現解析の結果を、遺伝子発現産物であるタンパク質間の物理的相互作用が網羅されているデータベース※2に重ね合わせる、“遺伝子ネットワーク解析”を行いました(図1、中央)。
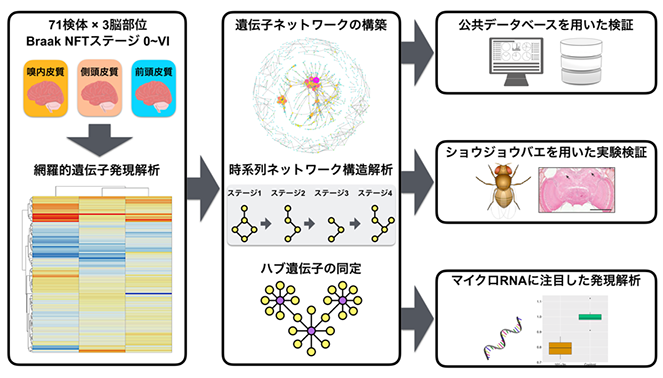
図1 本研究の実験の流れ
その結果、ADの進行とともに起こる遺伝子発現の変化により、神経細胞の中で重要な機能を担うタンパク質間の相互作用の多くが失われることが分かりました。それらの中でも、記憶形成の本体であるシナプス形成や、神経細胞の生存にかかわることが知られるRAC1遺伝子が、遺伝子ネットワークの中で数多くの繋がりを持つ“ハブ”として働き、その発現低下はタンパク質間の相互作用の崩壊に大きく寄与することが予測されました。さらに、この傾向は記憶を司る嗅内皮質でもっとも顕著でした。
公共のデータベースを用いた解析から、RAC1の発現低下は欧米人のAD患者脳でも確認され、またショウジョウバエ脳においてこのRAC1遺伝子の働きを弱めることで、老化に伴う神経変性が惹起されることを示しました。さらにAD患者脳内でRAC1遺伝子の発現低下を引き起こす原因として、hsa-miR-101-3pというマイクロRNA※3の発現が上昇し、その結果RAC1遺伝子の発現が抑制される可能性を見出しました(図1、右)。
今後、本研究で示したような遺伝子ネットワーク解析をさらに利用することで、不明な点の多いAD発症メカニズムを、まったく新たな角度から解明できる可能性があります。またそれらの知見は、より効果的なAD治療薬の開発につながると期待できます。
本研究成果は、1月16日に英国科学誌「Human Molecular Genetics」オンライン版に掲載されました。また大阪大学からは、1月24日付けでプレスリリースされました。
“Disruption of a RAC1-centred network is associated with Alzheimer’s disease pathology and causes age-dependent neurodegeneration”
Masataka Kikuchi1,†,*, Michiko Sekiya2,3,†, Norikazu Hara4,†, Akinori Miyashita4, Ryozo Kuwano4,5, Takeshi Ikeuchi4, Koichi M. Iijima2,3,*, and Akihiro Nakaya1(† 共同筆頭著者、* 責任著者)
なお、本研究は、長寿医療研究開発費、日本学術振興会、日本医療研究開発機構(AMED)長寿・障害総合研究事業・認知症研究開発事業「網羅的ゲノム解析とインフォマティクス統合解析による認知症の新規病態解析」の援助を受け行われました。
異常にリン酸化されたタウタンパク質による凝集体。
実験で調べたタンパク質間の物理的な相互作用をネットワークとして記述したデータ。ネットワークはノード(頂点)と、ノードとノードをつなぐリンク(辺)の集合と定義される。ここではタンパク質をノード、タンパク質間の物理的な相互作用をリンクと呼ぶ。
マイクロRNAは21-25塩基の長さを持つ1本鎖RNA分子。相補的な配列をもつメッセンジャーRNAと結合することでタンパクへの翻訳を阻害することが知られている。