国立研究開発法人国立長寿医療研究センター 認知症臨床研究・治験ネットワーク
臨床試験・治験とは(薬ができるまで)
薬ができるまで
私達が病気やけがをした時、多くは薬を使って治療が行われます。薬は効果があり、副作用が少ないことが大切です。
新しい薬が世の中に出てくるためには、最初に 『 薬 』 になる可能性のある化合物について試験管内での作用を調べます。 その中で、薬として役に立ち、なおかつ副作用が少ないと考えられる化合物のみを、健康な人の協力を得て使用していただき、どのように身体に吸収されたり排出されたりするのか、どのような副作用がどのくらいでるのかを確認します。 その結果、安全性が確認されたものを患者さんのご協力を得てご使用いただき、人の病気にどのくらい役立つのか、副作用がどのくらいでるのかを確認します。
このため、製薬企業は病院に依頼して、新しい薬の候補が病気の治療に有効かどうかを調べています。 製薬企業はこれらの結果をまとめて厚生労働省に提出し、厚生労働省はその結果について厳格な審査を行い、医薬品として有用性のあるものを承認します。そして市場にでることにより、私達が病院からもらう薬となります。
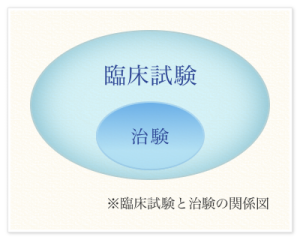
臨床試験、治験とは
薬が厚生労働省から承認を受けるまでの過程であり、人での有効性や安全性について調べる試験を一般に 『 臨床試験 』 と言います。また、その中で、厚生労働省から薬として承認を受けるために行う臨床試験のことを 『 治験 』 と言います。 そのため治験は国が定めた 『 薬事法 』 や 『 医薬品の臨床試験の実施の基準 ( GCP ) 』 などの法律を守って実施されています。治験を行うには、治験を行う医師が患者さんに治験について十分説明し、患者さんがその内容をよく理解された上でご本人自らの考え ( 判断 ) により治験に参加されることに同意 ( インフォームドコンセントといいます ) していただく必要があります。
治験のすすめ方
『 薬の候補物質 』を用いてまず初めに動物で効果や安全毒性についての試験 ( 非臨床試験 ) を実施し、これらを十分確認してから、治験に進みます。
治験では3つの段階 ( フェーズまたは相と言います ) があり、順番に各段階での有効性や安全性を確認しながら開発を進めます。 治験として実施した各試験の結果は、承認申請の際、厚生労働省に提出する資料になります。
■ フェーズⅠ
少人数の健康成人でごく少量から少しずつ薬の候補物質の量を増やしていき、安全性について調べます。
■ フェーズⅡ
薬の候補物質が効果を示すと予想される比較的少人数の患者さんで、有効性、安全性、投与量、投与方法などを調べます。
■ フェーズⅢ
多数の患者さんで有効性、安全性、投与量、投与方法などを確認します。





