ホーム > 病院 > 新着情報一覧 > 鷲見幸彦病院長らの研究グループは、日本人の一般人口におけるレビー小体病の前駆症状(prodromal症状)の保有率を明らかにし、自覚症状を有しない50歳以上の健診受診者の5.7%に2つ以上の前駆症状を有するハイリスク者が存在することを見出しました



令和2年2月7日
国立大学法人名古屋大学
国立研究開発法人国立長寿医療研究センター
国立研究開発法人日本医療研究開発機構
名古屋大学大学院医学系研究科神経内科学の勝野雅央教授、服部誠客員研究員(筆頭著者)、国立長寿医療研究センターの鷲見幸彦病院長らの研究グループは、難治神経変性疾患※1の一つであるレビー小体病(パーキンソン病(PD)※2とレビー小体型認知症(DLB)※3を合わせた疾患概念)を対象にした臨床研究において、日本人の一般人口におけるレビー小体病の前駆症状(prodromal症状)の保有率を明らかにし、自覚症状を有しない50歳以上の健診受診者の5.7%に2つ以上の前駆症状を有するハイリスク者が存在することを見出しました。
レビー小体病は、αシヌクレイン※4の神経細胞内の蓄積を病理学的な特徴に持つ神経変性疾患であり、パーキンソン病とレビー小体型認知症を含む疾患概念です。近年、レビー小体病では神経症状が発症する10〜20年前から便秘やREM期睡眠行動異常症(RBD)※5、嗅覚低下などの前駆症状を呈することが注目されていましたが、日本人の一般人口における前駆症状の保有率は明らかではありませんでした。
勝野教授らの研究チームは、久美愛厚生病院(岐阜県高山市)、だいどうクリニック(愛知県名古屋市)の健診センターと連携し、これらの施設の健診受診者(年間12,378名)を対象にしたレビー小体病の前駆症状に関する質問紙調査とハイリスク者のレジストリ(登録システム)構築を目的として、研究を実施しました。その結果、50歳以上の健診受診者の5.7%が2つ以上の前駆症状を有するハイリスク者に該当し、男性のハイリスク者では貧血やコレステロールに関する採血項目で、前駆期のレビー小体病患者に類似した低値を示すことを明らかにしました。
神経症状を有しないハイリスク者を通常診療で同定することは極めて困難ですが、本研究の結果から、健康診断制度を活用したレジストリの活用により、質問紙による簡便な調査で神経変性疾患のハイリスク者の抽出が可能であることが示されました。今後、レビー小体病の先制治療を目指したハイリスク者の臨床研究に着手する予定です。
本研究成果は、2020年2月7日付(日本時間10時30分)に米国科学雑誌「Journal of Neurology」(電子版)に掲載されます。
認知症を含む神経変性疾患では、異常蛋白質の蓄積が臨床症状の発症に10〜20年以上先行して生じていることが明らかになってきており、発症前に病態を抑制することが重要であると認識されています(図1)。レビー小体病は、αシヌクレインの神経細胞内の蓄積を病理学的な特徴とする神経変性疾患であり、パーキンソン病(PD)とレビー小体型認知症(DLB)を含む疾患概念です。PDは動作緩慢などの運動障害と認知機能障害を呈し、国内患者数は20万人程度と推定されています。一方、DLBは国内患者数が60~90万人程度と推定されるアルツハイマー型認知症に次いで、頻度の高い認知症であり、幻視などの認知機能障害とパーキンソン病に似た症状を呈します。PDに対してはL-dopaを始めとするドーパミンに関連する薬剤やゾニサミドなどの非ドーパ薬、またDLBに対してはドネペジルとゾニサミドという治療薬として承認され臨床で使用されていますが、これらの治療薬には長期的な効果や副作用の面で限界があり、特にPDでは発症後数年は内服治療により運動症状が比較的良好にコントロールされますが、その後はウェアリングオフ※6やジスキネジア※7などの運動障害が高度になることが知られています。その主な要因として、神経症状の発症時にすでに神経変性が進行していることが挙げられます。たとえば、PD患者では発症時にすでに50%以上のドーパミンの神経細胞が脱落(死滅)していることが知られており、神経症状を発症するまでの期間に神経変性を抑制する疾患修飾療法※8を開始することが必要と考えられています。
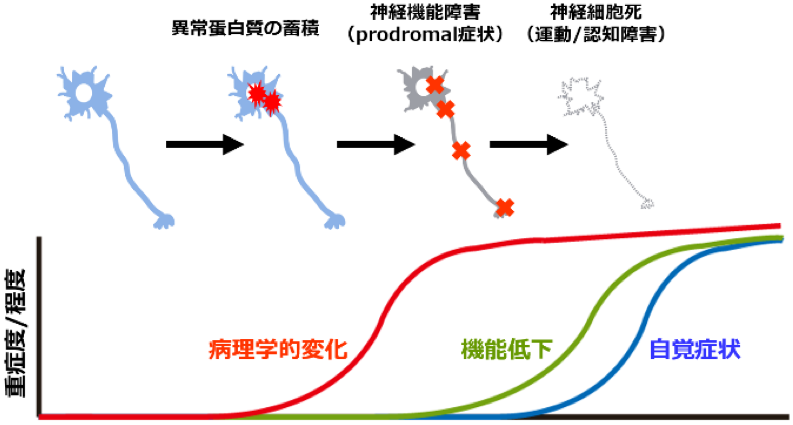
図1.神経変性病態の継時変化
近年、レビー小体病では神経症状の発症10~20年前から便秘やREM期睡眠行動異常症(RBD)、嗅覚低下などの前駆症状(prodromal症状)を呈することが注目されています。また、画像検査(ドーパミントランスポーターシンチグラフィー(DaT SPECT)※9やMIBG心筋シンチグラフィー※10)による早期診断も可能であることが明らかになりつつあります。一方で、日本人の一般人口における前駆症状の保有率は、十分に明らかになっておらず、神経症状を発症する前のハイリスク者を抽出する方法は不明でした。
そこで、われわれは、久美愛厚生病院(岐阜県高山市)、だいどうクリニック(愛知県名古屋市)の健診センターと連携し、これらの施設の健診受診者(年間12,378人)を対象にしたレビー小体病の前駆症状に関する調査とハイリスク者のレジストリ構築を目的に本研究を実施しました(図2)。
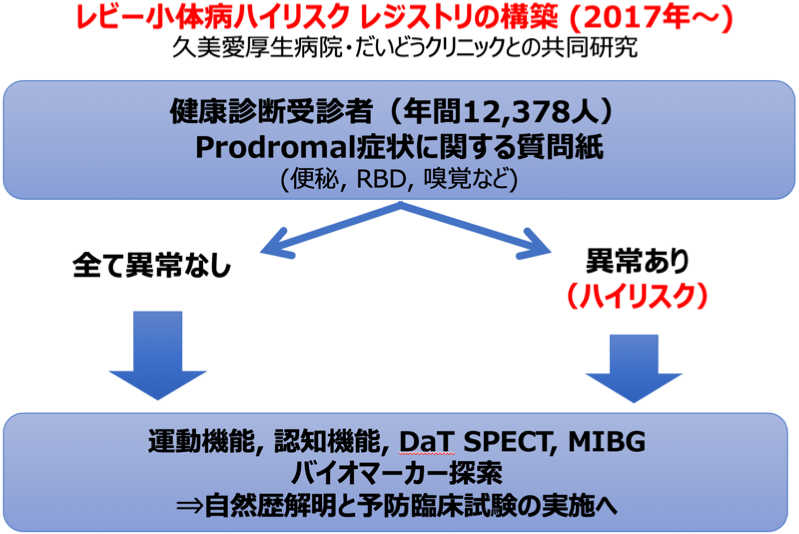
図2.研究デザイン
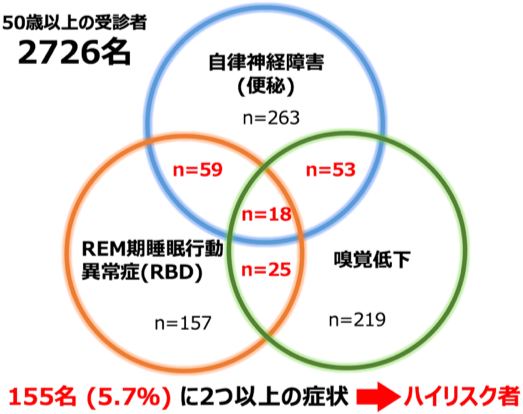
図3.質問紙調査によるハイリスク者の同定
本研究の結果、自覚症状がない4,953名の健診受診者から得られた自記式調査票(RBDSQ-J、SAOQ、SCOPA-AUT日本語版など)の解析において、50歳以上の2,726名の受診者の5.7%にあたる155名が、RBD、嗅覚低下、自律神経障害(便秘)のうち、2つ以上の前駆症状を有しているレビー小体病ハイリスク者であることが明らかになりました(図3)。これらのハイリスク者では、うつや日中の眠気といった他の前駆症状のスコアも高値であり、レビー小体病患者に広い範囲で類似した前駆症状を有していました(表1)。また、男性のハイリスク者ではヘモグロビン(Hb)、赤血球数(RBC)、ヘマトクリット(Hct)などの貧血に関するマーカーや、総コレステロール(T-Cho)、LDLコレステロール(LDL-Cho)が低値でした(表2)。先行研究において、貧血や低コレステロールは将来のPD発症のリスク因子であることが報告されており、われわれが抽出したハイリスク者でも同様の結果が得られました。自覚症状がない者は病院を受診しないため、神経症状がないハイリスク者を通常診療で同定することは困難ですが、健康診断制度と連携したレジストリを活用することで、神経変性疾患・認知症のリスク評価が可能であることが示されました。
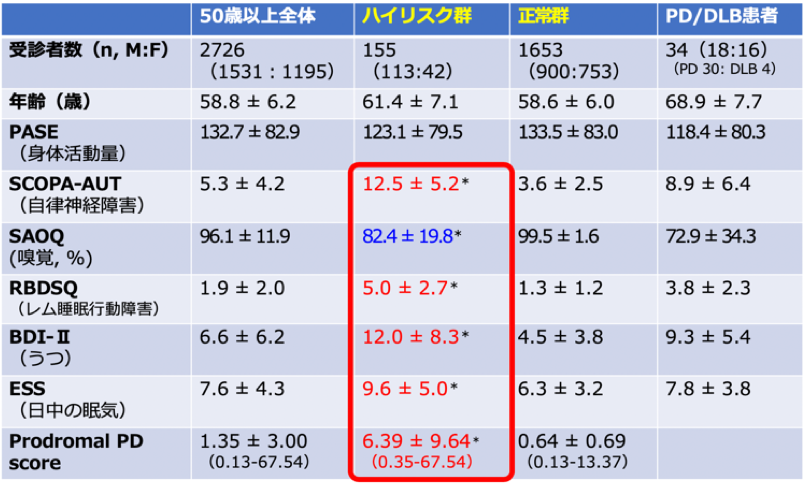
表1,ハイリスク群のprodromal症状
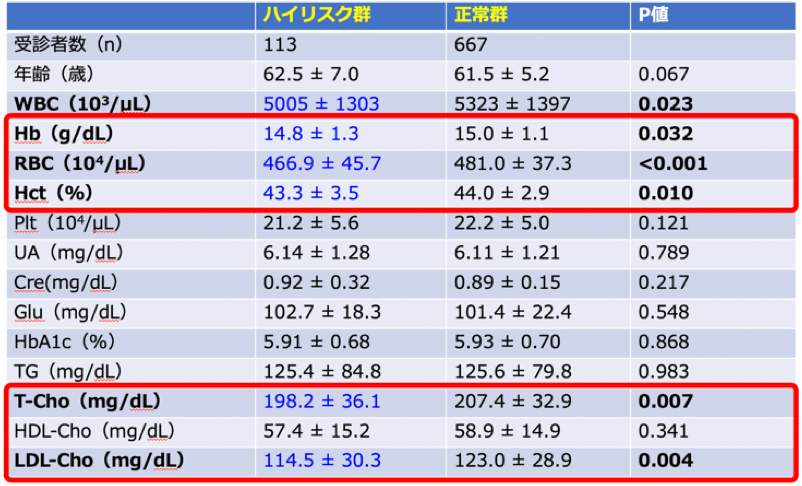
表2.男性ハイリスク者の採血結果
本研究の結果、50歳以上の健診受診者の中に、2つ以上の前駆症状を有するレビー小体病のハイリスク者が5.7%存在することが明らかになりました。その後、われわれは質問紙によって抽出したハイリスク者に対して、運動機能、認知機能、生理検査、画像検査(DaT SPECT、MIBG心筋シンチグラフィー)等のレビー小体病に関する二次精査を実施しており、神経症状を有しないもののDaT SPECTやMIBG心筋シンチグラフィーなどのレビー小体病に特徴的な画像の異常を呈する者が存在することを見出しています(未発表)。将来的には、われわれが見出した前駆期のレビー小体病患者に対して、疾患の発症を遅らせる先制治療の臨床研究に着手する予定です。
Journal of Neurology
Subjects at risk of Parkinson’s disease in health checkup examinees: cross-sectional analysis of baseline data of NaT-PROBE study
Makoto Hattori, MD1, Takashi Tsuboi, MD, PhD1,2, Katsunori Yokoi, MD1, Yasuhiro Tanaka, PhD1, Maki Sato1, Keisuke Suzuki, MD, PhD3, Yutaka Arahata, MD, PhD4, Akihiro Hori, MD, PhD5, Motoshi Kawashima, MD6, Akihiro Hirakawa, PhD7, Yukihiko Washimi, MD, PhD4, Hirohisa Watanabe, MD, PhD8,9, Masahisa Katsuno, MD, PhD1
10.1007/s00415-020-09714-6.
本研究は、国立研究開発法人日本医療研究開発機構の認知症研究開発事業の支援を受けて実施いたしました。
名古屋大学医学系研究科 神経内科学 教授 勝野雅央
TEL:052-744-2389 FAX:052-744-2384
E-mail:ka2no@med.nagoya-u.ac.jp
名古屋大学医学部・医学系研究科総務課総務係
TEL:052-744-2228 FAX:052-744-2785
E-mail:iga-sous@adm.nagoya-u.ac.jp
国立研究開発法人日本医療研究開発機構 戦略推進部 脳と心の研究課
E-mail: brain-d@amed.go.jp
![]()