吉田裕孝 (薬理学研究室長)

はじめに
認知症を発症する患者さんの脳神経細胞にはタウとよばれるタンパク質の蓄積がみられます。タウは神経細胞が正しく機能し情報を伝達できるように細胞の形を維持するはたらきをしています。
しかし、認知症患者さんの神経細胞内では病気の進行にともないリン酸化とよばれる修飾を多くうけ、線維状の形態で蓄積しているタウ(タウ線維)が多く観察されるようになり、結果として神経細胞が変性・消失すると考えられます(図1)。
このようなタウの病気の進行に伴う変化を抑えることで認知症発症と進行を防ぐことが可能と考え、タウを標的とした抗認知症治療・予防薬ならびに治療法の開発を目指しています。
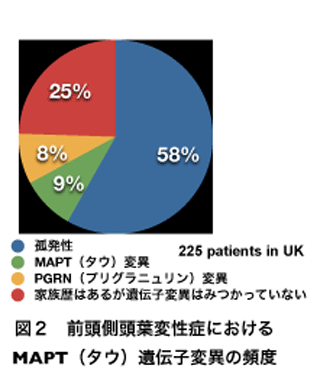
パーキンソン病など運動機能に異常のみられる神経変性疾患でも特定のタンパク質が神経細胞内に蓄積することもしられています。これらの病気は特定のタンパク質が蓄積する共通点があるのでproteinopathyプロテイノパチーと総称されます。
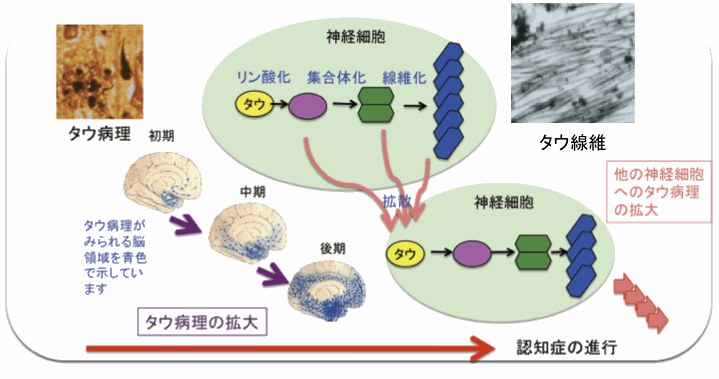
図1 認知症の進行にともなうタウの分子ならびにタウ病理の変化